
【题目】世上万物,神奇可测。其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_________(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为_________________,Q2+的未成对电子数是______。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4
①铜元素在周期表中的位置是________________,[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为_____________________。
②[Cu(NH3)4]SO4中,存在的化学键的类型有_______(填字母)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
③NH3中N原子的杂化轨道类型是________,写出一种与SO42-互为等电子体的分子的化学式:__________。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________________。
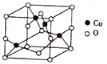
(4)氧与铜形成的某种离子晶体的晶胞如图所示,则该化合物的化学式为_________。若该晶体的密度为 ρ g·cm-3,则该晶体内铜离子与氧离子间的最近距离为_____________(用含 ρ 的代数式表示,其中阿伏加德罗常数用NA表示)cm。
【答案】B 3d84s2 4 第四周期IB族 N>O>S ACE sp3 CCl4(或其他合理答案) 平面正方形 CuO ![]()
【解析】
(1)根据价层电子对互斥理论确定分子的空间构型及原子杂化方式,价层电子对数=键合电子对数+孤电子对数,据此分析解答;
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,说明Q、T处于元素周期表的VIII族,结合原子序数T比Q多2,判断出两种元素,再结合核外电子排布规律解答;
(3)①同主族自上而下第一电离能减小,同周期随原子序数增大元素第一电离能呈增大趋势,N元素原子2p能级为半充满稳定状态,第一电离能高于氧元素的第一电离能;②配离子与外界硫酸根形成离子键,铜离子与氨分子之间形成配位键,氨分子、硫酸根中原子之间形成极性键;③NH3中N原子形成3个N-H键,含有1对孤电子对,杂化轨道数目为4;SO42-有5个原子、价电子总数为32,平均价电子数为6.4,应是价电子数为7的4个原子与价电子数为4的一个原子构成的微粒;④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,结合正四面体和平面正方形结构分析判断;
(4)晶体内铜离子与周围最近的4个氧离子形成正四面体结构,晶胞顶点铜离子与小正四面体中心氧离子连线处于晶胞体对角线上,且二者距离等于体对角线长度的![]() ,利用均摊法计算晶胞中铜离子、氧离子数目,结合摩尔质量计算晶胞中各微粒总质量,再由密度可以得到晶胞体积,从而得到晶胞棱长,据此分析解答。
,利用均摊法计算晶胞中铜离子、氧离子数目,结合摩尔质量计算晶胞中各微粒总质量,再由密度可以得到晶胞体积,从而得到晶胞棱长,据此分析解答。
(1)A.BeCl2分子中,铍原子含有两个共价单键,不含孤电子对,所以价层电子对数是2,中心原子以sp杂化轨道成键,分子的立体构型为直线形,故A错误;B.水分子中孤电子对数=![]() =2,水分子中氧原子含有2个共价单键,所以价层电子对数是4,中心原子以sp3杂化轨道成键,价层电子对互斥模型为四面体型,含有2对孤对电子,分子的立体构型为V形,故B正确;C.HCHO分子内(H2C=O)碳原子形成3个σ键,无孤对电子,分子中价层电子对数=3+0=3,杂化方式为sp2杂化,价层电子对互斥模型为平面三角形,没有孤电子对,分子的立体构型为平面三角形,故C错误;D.二硫化碳分子中碳原子含有2个σ键且不含孤电子对,采用sp杂化,其空间构型是直线形,故D错误;故答案为:B;
=2,水分子中氧原子含有2个共价单键,所以价层电子对数是4,中心原子以sp3杂化轨道成键,价层电子对互斥模型为四面体型,含有2对孤对电子,分子的立体构型为V形,故B正确;C.HCHO分子内(H2C=O)碳原子形成3个σ键,无孤对电子,分子中价层电子对数=3+0=3,杂化方式为sp2杂化,价层电子对互斥模型为平面三角形,没有孤电子对,分子的立体构型为平面三角形,故C错误;D.二硫化碳分子中碳原子含有2个σ键且不含孤电子对,采用sp杂化,其空间构型是直线形,故D错误;故答案为:B;
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,Ni元素是28号元素,Ni原子价电子排布式为3d84s2,Fe2+的核外电子排布式为1s22s22p63s23d6,3d能级有4个未成对电子,故答案为:3d84s2;4;
(3)①Cu处于周期表中第四周期ⅠB族;同主族自上而下第一电离能减小,同周期随原子序数增大元素第一电离能呈增大趋势,N元素原子2p能级为半充满稳定状态,第一电离能高于氧元素的第一电离能,故第一电离能:N>O>S,故答案为:第四周期ⅠB族;N>O>S;
②配离子与外界硫酸根形成离子键,铜离子与氨分子之间形成配位键,氨分子、硫酸根中原子之间形成极性键,不存在金属键,故选:ACE;
③NH3中N原子形成3个N-H键,含有1个孤电子对,杂化轨道数目为4,故N原子采取sp3杂化;SO42-有5个原子、价电子总数为32,平均价电子数为6.4,应是价电子数为7的4个原子与价电子数为4的一个原子构成的微粒,可以是CCl4等,故答案为:sp3;CCl4;
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,说明[Cu(NH3)4]2+是平面正方形,故答案为:平面正方形;
(4)晶体内铜离子与周围最近的4个氧离子形成正四面体结构,晶胞顶点铜离子与小正四面体中心氧离子连线处于晶胞体对角线上,且二者距离等于体对角线长度的![]() ,而晶胞体对角线长度等于晶胞棱长的
,而晶胞体对角线长度等于晶胞棱长的![]() 倍。晶胞中铜离子处于晶胞内部,有4个,氧离子处于顶点与面心,共有8×
倍。晶胞中铜离子处于晶胞内部,有4个,氧离子处于顶点与面心,共有8×![]() +6×
+6×![]() =4,化学式为CuO;晶胞中铜离子、氧离子总质量=
=4,化学式为CuO;晶胞中铜离子、氧离子总质量=![]() g,晶胞体积=
g,晶胞体积=![]() g÷ρg/cm3=
g÷ρg/cm3=![]() cm3,则晶胞棱长=
cm3,则晶胞棱长=![]() cm,故晶体内铜离子与氧离子间的最近距离为:
cm,故晶体内铜离子与氧离子间的最近距离为:![]() ×
×![]() ×
×![]() cm=
cm=![]() ×
×![]() cm,故答案为:CuO;
cm,故答案为:CuO;![]() ×
×![]() 。
。


科目:高中化学 来源: 题型:
【题目】某溶液改变一个条件,酸性一定增大的是
A.酸雨在空气中放置一段时间B.使溶液中c(H+)增大
C.使溶液中c(OH-)减小D.稀盐酸露置于空气中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:(8分钟时A为0.2mol 、B为0.5mol)
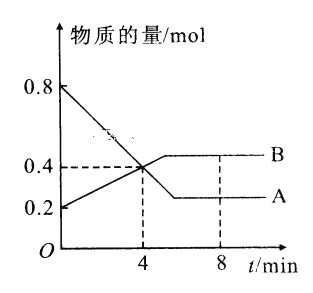
(1)该反应的化学方程式为_________________________。
(2)反应开始时至4min时,A的平均反应速率为________。
(3)4min时,反应是否达平衡状态?________(填“是”或“否”), 8min时,V正________V逆(填“>”“<”或“=”)。
II.在2L密闭容器中,800℃时反应2NO(g)+O2(g) →2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。
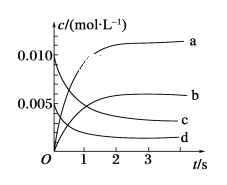
(3)能说明该反应已达到平衡状态的是________(填序号)。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c. v逆(NO)=2v正(O2) d. 容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”的理想状态是反应物的原子全部转化为目标产物。以下反应不符合绿色化学原则的是
A. 工业生产环氧乙烷:![]()
B. 水煤气合成甲醇:CO + 2H2催化剂CH3OH
C. 制取硫酸铜:Cu + 2H2SO4(浓)加热CuSO4 + SO2↑+ 2H2O
D. 合成甲基丙烯酸甲酯:CH3C≡CH + CO + CH3OH Pd CH2=C(CH3)COOCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】补齐下列物质间的反应与对应反应类型的连线。
A. 从乙烯得到聚乙烯的反应 | a. 氧化反应 |
B. 乙醇与酸性重铬酸钾溶液反应 | b. 加聚反应 |
C. 乙烯与溴的四氯化碳溶液反应 | c. 取代反应 |
D. 乙酸和乙醇在浓硫酸作用下的反应 | d. 加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g)+nB(g) ![]() pC(g) △H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )
pC(g) △H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )

A. T1<T2,P1>P2,m+n>p,△H>0
B. T1>T2,P1<P2,m+n>p,△H>0
C. T1>T2,P1<P2,m+n<p,△H<0
D. T1>T2,P1>P2,m+n>p,△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. SiO2![]() SiCl4
SiCl4![]() Si B. CuSO4
Si B. CuSO4![]() Cu(OH)2
Cu(OH)2![]() Cu
Cu
C. 饱和NaCl(aq)![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3(s) D. FeS2(s)
Na2CO3(s) D. FeS2(s)![]() SO3(g)
SO3(g)![]() H2SO4
H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:C(s)+H2O(g)![]() CO(g)+H2(g)△H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:
CO(g)+H2(g)△H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:
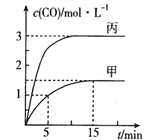
容器 | 甲 | 乙 | 丙 |
容积(L) | 0.5 | 0.5 | V |
温度(℃) | T1 | T2 | T1 |
起始量 | 1mol C(s) 1mol H2O(g) | 1mol CO(g) 1mol H2(g) | 3mol C(s) 2mol H2O(g) |
下列说法正确的是
A. 甲容器中,反应在5~15mim间的平均速率v(CO)=0.15mol·L-1·min-1
B. 温度为T1℃时,反应的平衡常数K=9
C. 乙容器中,若平衡时n(C)=0.2mol,则T2<T1
D. 丙容器的体积V=0.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com