
【题目】某溶液改变一个条件,酸性一定增大的是
A.酸雨在空气中放置一段时间B.使溶液中c(H+)增大
C.使溶液中c(OH-)减小D.稀盐酸露置于空气中
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某化学小组的同学取一定量的Al和Fe2O3的混合物进行铝热反应,并探究熔落物的成分。请回答下列问题:
Ⅰ.(1)引发铝热反应的实验操作是_____________________
(2)做铝热反应时,内层纸漏斗底部剪一小孔用水润湿的目的是_________________
(3)反应的化学方程式为_____________
Ⅱ.已知:Al、Fe的熔、沸点数据如下:
物质 | Al | Fe |
熔点(℃) | 660 | 1 535 |
沸点(℃) | 2 467 | 2 750 |
(1)某同学猜测,铝热反应所得到的熔落物是铁铝合金。理由:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金。你认为他的解释是否合理?____________(填“合理”或“不合理”)。设计一个简单的实验方案,证明上述所得的熔落物中含有金属铝:_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种可做融雪剂的盐,其主要成分的化学式为XY2 , X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1mol XY2含有54mol电子。
(1)该融雪剂的化学式是_________;用电子式表示XY2的形成过程__________________。
(2)主族元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻, 则D的离子结构示意图是_________;D与E能形成一种类似于CO2的三原子分子,且每个原子均达到了8e稳定结构,该分子的化学键类型为_________(填“离子键”或“共价键”)。
(3)用化学式回答:
①D与Y的氢化物稳定性________>________;
②D与Y的最高价氧化物对应水化物酸性________>________。
(4)某兴趣小组设计的简易原电池装置如下图所示。回答下列问题:

①锌片为_____极(填“正”或“负”)。
②电池正极的现象是_________________,其电极反应式为_____________________。
③电流由_______经导线流向______(填“锌片”或“碳棒”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸。
某实验小组拟探究CaO2的性质及其实验室制法。
(1)实验探究CaO2与酸的反应。
操作 | 现象 |
向盛有4 g CaO2的大试管中加入10mL稀盐酸得溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
取5 mL溶液a于试管中,滴入两滴石蕊试液 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
①CaO2与盐酸反应的化学方程式为_______________________________。
②加入石蕊试液后溶液褪色可能是因为溶液a中存在较多的_________。
(2)用如图所示装置制备过氧化钙,其反应原理为Ca+O2![]() CaO2。
CaO2。
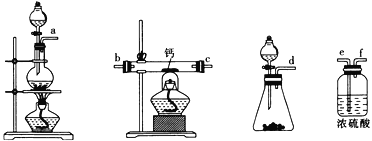
①请选择实验所需要的装置,按气流方向连接的顺序为______________________(填仪器接口的字母,上述装置可不选用也可重复使用)。
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,_________________________________(填操作);Ⅳ.拆除装置,取出产物。
(3)利用反应:Ca2++ H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图所示。

①NH3在Ca2+和H2O2的反应过程中所起的作用是______________________。
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。过滤需要的玻璃仪器是_________;将沉淀进行洗涤的操作为_____________________________________________。
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从海带中提取碘的部分流程如下:
![]()
下列说法不正确的是
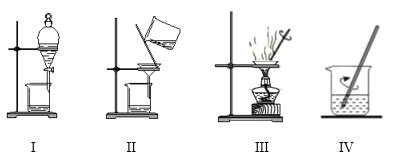
A. 完成步骤①需要装置IIIB. 完成步骤③需要装置II
C. 完成步骤⑤需要装置ID. 完成步骤②和④需要装置IV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是________(填元素符号)。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是________,其氢化物的电子式是_________。
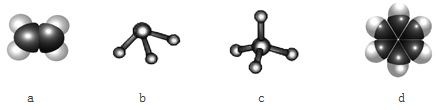
(3)元素①和②可以形成多种化合物。下图模型表示的分子中,不可能由①和②形成的是_______(填序号)。
(4)比较元素②、③的最高价氧化物对应水化物的酸性:______>______(填化学式)。说明你判断的理由:_________。
(5)主族元素砷(As)的部分信息如图所示。
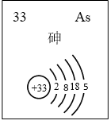
i.砷(As)在周期表中的位置是______。
ii.下列说法正确的是_______(填序号)。
a. 砷元素的最高化合价为+4
b. 推测砷有多种氧化物
c. ③的气态氢化物的还原性大于砷的气态氢化物的还原性
(6)某小组同学设计实验比较VIIA元素的非金属性:Cl>Br>I。
已知:常温下浓盐酸与高锰酸钾反应生成氯气。
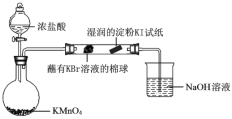
打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙红色,湿润的淀粉KI试纸变蓝,据此现象能否说明非金属性:Br > I,并说明理由_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世上万物,神奇可测。其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_________(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为_________________,Q2+的未成对电子数是______。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4
①铜元素在周期表中的位置是________________,[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为_____________________。
②[Cu(NH3)4]SO4中,存在的化学键的类型有_______(填字母)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
③NH3中N原子的杂化轨道类型是________,写出一种与SO42-互为等电子体的分子的化学式:__________。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________________。
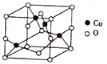
(4)氧与铜形成的某种离子晶体的晶胞如图所示,则该化合物的化学式为_________。若该晶体的密度为 ρ g·cm-3,则该晶体内铜离子与氧离子间的最近距离为_____________(用含 ρ 的代数式表示,其中阿伏加德罗常数用NA表示)cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com