
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. SiO2![]() SiCl4
SiCl4![]() Si B. CuSO4
Si B. CuSO4![]() Cu(OH)2
Cu(OH)2![]() Cu
Cu
C. 饱和NaCl(aq)![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3(s) D. FeS2(s)
Na2CO3(s) D. FeS2(s)![]() SO3(g)
SO3(g)![]() H2SO4
H2SO4
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关元素的性质及其递变规律正确的是
A. ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物
B. 第二周期元素从左到右,最高正价从+1递增到+7
C. 同主族元素从上到下金属性越来越弱
D. 同周期金属元素的最外层电子越多,其原子失电子能力越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子可能大量共存的是
A. 不能使酚酞试液变红的无色溶液中:Na+、CO![]() 、K+、ClO-、AlO
、K+、ClO-、AlO![]()
B. 常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO![]()
C. 能与金属铝反应放出氢气的溶液中: K+、NO![]() 、Cl-、NH
、Cl-、NH![]()
D. 含有HCO![]() 的溶液中:K+、OH-、NO
的溶液中:K+、OH-、NO![]() 、Ca2+
、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是________。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有①水、②碘化钾淀粉试纸、③淀粉、④白酒、
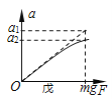
⑤食醋,你认为必须选用的物质有________(填序号)。
(3)请配平以下化学方程式:
______________________________
若反应过程中转移5 mol电子,则生成标准状况下N2的体积为________L。
Ⅱ.“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。
(4)请写出金属钒与浓硝酸反应的离子方程式:_______________________________。
(5)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学将铁铝合金样品溶解后取样25.00 mL,分离并测定Fe3+的浓度,实验方案设计如下:
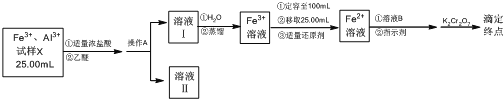
已知:乙醚[(C2H5)2O]是一种易挥发、易燃、有麻醉性的有机化合物,沸点为34.5 ℃,微溶于水。在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚;当盐酸浓度降低时,该化合物解离。
请回答:
(1)操作A的名称是____________。
(2)经操作A后,为判断Fe3+是否有残留,请设计实验方案___________。
(3)滴定前,加入的适量溶液B是________。
A.H2SO3H3PO4 B.H2SO4H3PO4 C.HNO3H3PO4 D.HIH3PO4
(4)滴定达到终点时,消耗0.100 0 mol·L-1 K2Cr2O7溶液6.00 mL。根据该实验数据,试样X中c(Fe3+)为________。
(5)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是________。
A.稀释被测试样 B.减少被测试样取量
C.增加平行测定次数 D.降低滴定剂浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应能用离子方程式:H++OH-=H2O。表示的是( )
A.CH3COOH+NaOH=CH3COONa+H2O
B.2H2SO4+Cu(OH)2=CuSO4+2H2O
C.HCl+KOH=KCl+H2O
D.HCl+NH3·H2O=NH4Cl+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Zn+2HCl=ZnCl2+H2的反应,下列说法正确的是( )
A.单质Zn中Zn的化合价升高,被还原,是氧化剂
B.HCl中H的化合价降低,被氧化,HCl是还原剂
C.H2是还原产物
D.该反应是复分解反应,也是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
![]()
(1)写出A、B、C三元素名称________、________、________。
(2)C在元素周期表中的位置是____________________。
(3)B的原子结构示意图为________________,C的氢化物与B的氢化物的稳定性强弱顺序为________>________(填化学式)。
(4)比较A、C的原子半径A________C,写出A的气态氢化物与A的最高价氧化物对应水化物反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)试管Ⅰ和Ⅱ中分别加入3 mL稀盐酸(均足量),再将装0.3 g NaHCO 3和0.3 g Na2CO3粉末的小气球分别套在试管Ⅰ和Ⅱ的管口。将气球内的 NaHCO3和Na2CO3同时倒入试管中,请回答下列问题:

①试管Ⅰ中发生反应的离子方程式为________。
②加入固体后,试管_______(填 “Ⅰ”或“Ⅱ”)上的气球膨胀较快。
(2)为研究Na2CO3、NaHCO3与盐酸的反应是吸热反应还是放热反应,某同学继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 | 35 mL试剂 | 固体 | 混合前温度/℃ | 混合后温度/℃ |
① | 水 | 2.5 g NaHCO3 | 20.0 | 18.5 |
② | 水 | 3.2 g Na2CO3 | 20.0 | 24.3 |
③ | 盐酸 | 2.5 g NaHCO3 | 20.0 | 16.2 |
④ | 盐酸 | 3.2 g Na2CO3 | 20.0 | 25.1 |
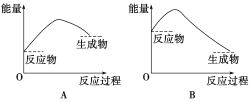
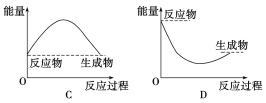
①设计1、2组实验的目的是:_______。
②通过上述实验可得出:NaHCO3溶液和盐酸的反应是_____反应,对应的图像为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com