
【题目】下列反应能用离子方程式:H++OH-=H2O。表示的是( )
A.CH3COOH+NaOH=CH3COONa+H2O
B.2H2SO4+Cu(OH)2=CuSO4+2H2O
C.HCl+KOH=KCl+H2O
D.HCl+NH3·H2O=NH4Cl+H2O
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】制取肥皂的实验有以下步骤:
①在一个干燥的蒸发皿中加入植物油8mL、乙醇8mL、NaOH溶液4mL
②在不断搅拌下,给蒸发皿中液体微微加热,直到混合物变稠
③继续加热,直到皂化反应完成
④把盛混合物的蒸发皿放在冷水浴中冷却.等待片刻,向混合物中加20mL热蒸馏水,再放在冷水中冷却.然后加入25mL NaCl饱和溶液充分搅拌
⑤用纱布滤出固体物质,弃去滤液.把固体物质挤于、压成条状、晾干,即得肥皂
根据实验,填空:
(1)在制肥皂时加入乙醇是利用了乙醇的什么性质?_________;
(2)如何验证皂化反应已完成?_________;
(3)在操作④中加入饱和NaCl溶液的作用是_________;
(4)写出硬脂酸甘油酯发生皂化反应的化学方程式_________;
(5)取用蒸发皿用的仪器是_________;
(6)工业上大规模生产用水蒸气加热的优点_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。下列说法正确的是( )
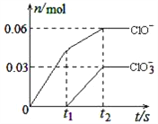
A. 苛性钾溶液中KOH的物质的量是0.09mol
B. ClO3-的生成是由于氯气的量的多少引起的
C. 在酸性条件下ClO-和ClO3-可生成Cl2
D. 反应中转移电子的物质的量是0.21mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空:
(1)镓(Ga)与铝同族,写出镓的氯化物和氨水反应的化学方程式____________。
(2)硅与铝同周期,SiO2是硅酸盐玻璃 (Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式____________________________________________。长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同,由钠长石化学式NaAlSi3O8可推知钙长石的化学式为_______________________。
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法 如:2Al+4BaO![]() 3Ba↑+BaO·Al2O3,常温下Al的金属性比Ba的金属性______(选填“强”“弱”)。利用上述方法可制取Ba的主要原因是________。
3Ba↑+BaO·Al2O3,常温下Al的金属性比Ba的金属性______(选填“强”“弱”)。利用上述方法可制取Ba的主要原因是________。
A.高温时Al的活泼性大于Ba B.高温有利于BaO分解
C.高温时BaO·Al2O3比Al2O3稳定 D.Ba的沸点比Al的低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. SiO2![]() SiCl4
SiCl4![]() Si B. CuSO4
Si B. CuSO4![]() Cu(OH)2
Cu(OH)2![]() Cu
Cu
C. 饱和NaCl(aq)![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3(s) D. FeS2(s)
Na2CO3(s) D. FeS2(s)![]() SO3(g)
SO3(g)![]() H2SO4
H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常把铝粉与某些金属氧化物的混合物称为铝热剂,下列氧化物中不能与铝粉发生铝热反应的是( )
A.Na2OB.Cr2O3C.MnO2D.V2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 合成氨反应是放热反应,所以工业上采用低温条件以提高氨的产率
B. 钢铁水闸可用牺牲阳极或外加电流的阴极保护法延缓其腐蚀
C. Na2O2与水反应产生1 mol O2,理论上转移的电子数约为4×6.02×1023
D. 保持温度不变,向稀氨水中缓慢通入CO2,溶液中![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用硼镁泥为原料制取MgSO4·7H2O粗产品的过程如下:
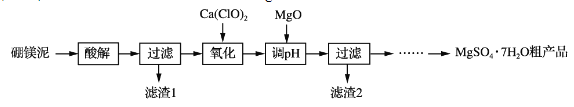
硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
(1)“酸解”时为提高Mg2+的浸出率,可采用的措施是_____(写一种)。所加酸不宜过量太多的原因是_____。
(2)“氧化”步骤中,若用H2O2代替Ca(ClO)2,则发生反应的离子方程式为______________。实际未使用H2O2,除H2O2成本高外,还可能的原因是______________________________________。
(3)“调pH”时用MgO而不用NaOH溶液的原因是________________________。
(4)结合附表信息,由MgSO4·7H2O粗产品(含少量CaSO4)提纯获取MgSO4·7H2O的实验方案如下:将粗产品溶于水,_________________________________________________,室温下自然挥发干燥。(实验中必须使用的试剂有:饱和MgSO4溶液,乙醇)附:两种盐的溶解度(g/100 g水)
温度℃ | 10 | 30 | 40 | 50 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com