
【题目】金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空:
(1)镓(Ga)与铝同族,写出镓的氯化物和氨水反应的化学方程式____________。
(2)硅与铝同周期,SiO2是硅酸盐玻璃 (Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式____________________________________________。长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同,由钠长石化学式NaAlSi3O8可推知钙长石的化学式为_______________________。
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法 如:2Al+4BaO![]() 3Ba↑+BaO·Al2O3,常温下Al的金属性比Ba的金属性______(选填“强”“弱”)。利用上述方法可制取Ba的主要原因是________。
3Ba↑+BaO·Al2O3,常温下Al的金属性比Ba的金属性______(选填“强”“弱”)。利用上述方法可制取Ba的主要原因是________。
A.高温时Al的活泼性大于Ba B.高温有利于BaO分解
C.高温时BaO·Al2O3比Al2O3稳定 D.Ba的沸点比Al的低
【答案】 GaCl 3+3NH3+3H2O=3NH4Cl+Ga(OH)3↓ SiO2+2NaOH=Na2SiO3+H2O CaAl2Si2O8 弱 D
【解析】(1)根据氯化铝与氨水反应书写方程式;
(2)二氧化硅与氢氧化钠溶液反应生成硅酸钠和水。根据不同类长石其氧原子的物质的量分数相同,结合化合价代数和是0可写出钙长石的化学式;
(3)常温下Al的金属性比Ba的金属性弱,该反应是利用Ba的沸点比Al的低。
(1)同主族元素化学性质相似,因此类比氯化铝与氨水的反应可得氯化稼与氨水反应的方程式,反应的化学方程式为GaCl3+3NH3+3H2O=3NH4Cl+Ga(OH)3↓;
(2)SiO2是酸性氧化物,可与NaOH作用生成可用作粘合剂的硅酸钠溶液,反应的方程式为SiO2+2NaOH=Na2SiO3+H2O;由“长石是铝硅酸盐”,结合钠长石的化学式可知钙长石就是将钠长石的中钠更换为钙,铝硅酸阴离子不变,以及化合物中化合价代数和等于0可得钙长石的化学式为CaAl2Si2O8;
(3)利用元素Ba、Al在元素周期表的位置可知金属活泼性:Al<Ba;但Al在高温下可将氧化钡中钡置换出来,原因是Ba的沸点低于铝,高温时Ba转化为气体脱离反应体系,使反应正向进行答案选D。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】某些稠环环芳烃的结构简式如图,下列说法正确的是( )
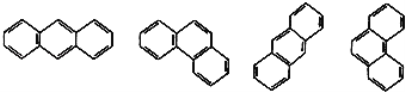
A. 这些结构简式表示的化合物有3种
B. 它们的分子式不相同
C. 所有原子均在同一平面
D. 它们与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烃B分子内C、H原子个数比为1:2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系:

(1)B的结构简式是_________________;
(2)A可能属于下列哪类物质__;
a.醇 b.卤代烃 c.酚 d.羧酸
(3)反应①是D与HCl按物质的量之比1:1的加成反应,则D的分子式是_____________,反应②可表示为:G+NH3→F+HCl (未配平),该反应配平后的化学方程式是____________(有机化合物均用结构简式表示);
化合物E(HOCH2CH2Cl)和 F[HN(CH2CH3)2]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知: )
)
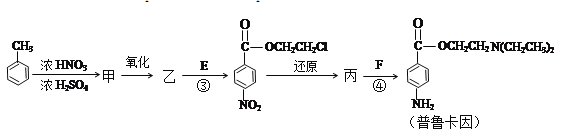
(4)甲的结构简式是__,由甲苯生成甲的反应类型是__;
(5)乙中有两种含氧官能团______,反应③的化学方程式是:______;
(6)丙中官能团的名称是______;
(7)普鲁卡因有两种水解产物丁和戊;
①戊与甲互为同分异构体,戊的结构简式是__;
②戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域.该聚合反应的化学方程式是__;
③D的红外光谱表明分子内除C﹣H键、C﹣C键外还含有两个C﹣O单键.则D与F在一定条件下反应生成丁的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是________。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有①水、②碘化钾淀粉试纸、③淀粉、④白酒、
⑤食醋,你认为必须选用的物质有________(填序号)。
(3)请配平以下化学方程式:
______________________________
若反应过程中转移5 mol电子,则生成标准状况下N2的体积为________L。
Ⅱ.“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。
(4)请写出金属钒与浓硝酸反应的离子方程式:_______________________________。
(5)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 醋酸溶解水垢中的CaCO3:CaCO3+2H+===Ca2++H2O+CO2↑
B. 铜与稀硝酸反应:3Cu+8H++2NO3—===3Cu2++2NO↑+4H2O
C. 用热的NaOH溶液溶解S:3S+4OH-![]() 2S2-+SO2↑+2H2O
2S2-+SO2↑+2H2O
D. 向氨水中通入过量SO2:2NH3·H2O+SO2===2NH![]() +SO32—+H2O
+SO32—+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应能用离子方程式:H++OH-=H2O。表示的是( )
A.CH3COOH+NaOH=CH3COONa+H2O
B.2H2SO4+Cu(OH)2=CuSO4+2H2O
C.HCl+KOH=KCl+H2O
D.HCl+NH3·H2O=NH4Cl+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图虚线框中的装置可用来检验浓硫酸与木炭粉的加热条件下反应产生的所有气体产物,填写下列空白:
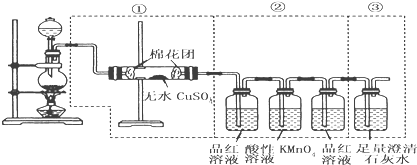
(1)如果装装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检出的物质是____________;不能检出的物质是____________。
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是____________;不能检出的物质是____________。
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是____________;不能检出的物质是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率有效的是:
A. Fe与稀硫酸反应制取H2时,改用浓硫酸
B. Na与水反应时增大水的用量
C. 在K2SO4与BaCl2两溶液反应时,增大压强
D. 密闭容器中进行的反应:C+O2![]() CO2,增大压强
CO2,增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com