
【题目】下列反应的离子方程式书写正确的是
A.将铜片插入稀硝酸中:![]()
B.稀硫酸与Ba(OH)2溶液反应:![]()
C.向A12(SO4)3溶液中加入过量氨水:![]()
D.向Na2SiO3溶液中滴加醋酸:![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量之比为

A.6:1B.3:1C.2:1D.1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某元素原子M层电子数是K层电子数的一半,该元素的原子结构示意图是______________。
(2)碘的质子数为53,碘有多种核素,其中中子数为74的核素的原子符号是________。
(3)某阳离子ARn+,核外共有x个电子,则该原子核内的中子数为 __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
I.实验步骤:
(1)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_______________作指示剂。
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为____________mL。

(4)滴定。当____________时,停止滴定,并记录NaOH溶液的最终读数.再重复滴定3次。
Ⅱ.实验记录
实验数据(mL) 滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理:
(5)某同学在处理数据时计算得:平均消耗的NaOH溶液的体积 V=![]() =15.24mL。指出他的计算的不合理之处:____________________________________。按正确数据处理,可得市售白醋总酸量=____________g/100mL。(结果保留四位有效数字)
=15.24mL。指出他的计算的不合理之处:____________________________________。按正确数据处理,可得市售白醋总酸量=____________g/100mL。(结果保留四位有效数字)
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)____________。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加入少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
(1)若12.4 g Na2X中含有0.4 mol钠离子,Na2X的摩尔质量是________,X的相对原子质量是________。
(2)标准状况,1L 水中通入 aL HCl 气体,忽略盐酸溶液中 HCl的挥发,得到的盐酸溶液密度为 b g/mL,则溶质的物质的量浓度为 __________mol/L
(3)某同学写出以下化学方程式(未配平)NO+HNO3―→N2O3+H2O该应中氧化剂是________(写化学式,下同) ;方程中出现的4种物质中还原性最强的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0.1mol/L的AlCl3溶液中不断加入NaOH溶液,体系中含铝微粒的分布分数随溶液pH的变化如图所示。下列说法错误的是

A.pH=4的溶液中:c(Al3+)>c[Al(OH)2+]>c[Al(OH)2+]
B.pH=4.5的溶液中:c(H+)+3c(Al3+)+2c[Al(OH)2+]+c[Al(OH)2+]=c(Cl-)+c(OH-)
C.pH=7时,向体系中再加入NaOH溶液,主要发生的离子反应为Al(OH)3+OH-=Al(OH)4-
D.pH=8时,向得到的溶液中通入CO2至饱和,主要发生的离子反应为2Al(OH)4-+CO2=2Al(OH)3↓+CO32-+H2O,CO32-+CO2+H2O=2HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KA1(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。采用废易拉罐制备明矾的过程如下图所示。
下列叙述错误的是
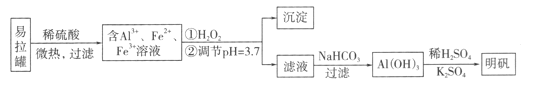
A. 合理处理易拉罐有利于环境保护和资源再利用
B. 从易拉罐中可回收的金属元素有Al、Fe
C. “沉淀”反应的金属离子为Fe3+
D. 上述流程中可用NaHSO4代替NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①写出二氧化碳的电子式:________________;
②写出赤铁矿石主要成份的化学式:___________________。
③写出氨分子的结构式:__________________。
(2)写出镁在二氧化碳中燃烧的化学方程式__________________________________________________。
(3)写出铜与氯化铁溶液反应的离子方程式:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
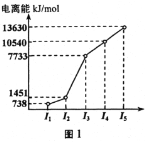
【题目】教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有___种不同运动状态的电子。
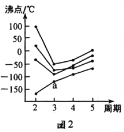
(2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___。
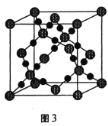
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于___晶体。
(4)第一电离能介于Al、P之间的第三周期元素有___种。GaCl3原子的杂化方式为___。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有___个紧邻分子。D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是___(填字母标号)。
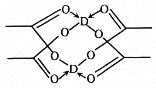
a.极性键 b.非极性键 c.配位键 d.金属键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com