
【题目】按要求回答下列问题
(1)若12.4 g Na2X中含有0.4 mol钠离子,Na2X的摩尔质量是________,X的相对原子质量是________。
(2)标准状况,1L 水中通入 aL HCl 气体,忽略盐酸溶液中 HCl的挥发,得到的盐酸溶液密度为 b g/mL,则溶质的物质的量浓度为 __________mol/L
(3)某同学写出以下化学方程式(未配平)NO+HNO3―→N2O3+H2O该应中氧化剂是________(写化学式,下同) ;方程中出现的4种物质中还原性最强的物质是________。
【答案】62 g/mol 16 ![]() HNO3 NO
HNO3 NO
【解析】
(1)12.4 g Na2X中含有0.4 mol钠离子,则Na2X的摩尔质量为![]() =62g/mol,由Na2X的相对分子质量为62可知,X的相对原子质量为(62—23×2)=16,故答案为62g/mol;16;
=62g/mol,由Na2X的相对分子质量为62可知,X的相对原子质量为(62—23×2)=16,故答案为62g/mol;16;
(2)标准状况,aL HCl 气体的物质的量为![]() mol,质量为
mol,质量为![]() mol×36.5g/mol=
mol×36.5g/mol=![]() g,标准状况,1L 水中通入 aL HCl 气体得到溶液的质量为(1000+
g,标准状况,1L 水中通入 aL HCl 气体得到溶液的质量为(1000+![]() )g,溶液的体积为
)g,溶液的体积为![]() ×10—3L/ml,则溶质的物质的量浓度为
×10—3L/ml,则溶质的物质的量浓度为![]() =
=![]() mol/L,故答案为
mol/L,故答案为![]() ;
;
(3)由化学方程式可知,反应中NO中的N元素化合价升高被氧化,NO是还原剂,HNO3中的N元素化合价降低被还原,HNO3是氧化剂,N2O3即是氧化产物又作还原产物,由还原剂的还原性强于还原产物可知,还原性最强的是NO,故答案为HNO3;NO。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0mol/LKNO3溶液:H+、Fe2+、SCN-、SO42-
B. pH =0的溶液:Al3+、CO32-、Cl-、SO42-
C.![]() 的溶液:K+、Ba2+、NO3-、Cl-
的溶液:K+、Ba2+、NO3-、Cl-
D.无色溶液:Na+、SO32-、Cu2+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.0500 mol·L-1H2C2O4溶液滴定 25.00 mL0.l000mol·L-1NaOH溶液所得滴定曲线如图。下列说法正确的是()
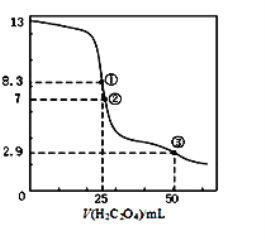
A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
B.点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C.点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D.滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)由N2、NO、CO2组成的混合气体中,三种成分的体积分数之比为1:2:1,则三种成分的质量比为________。
(2)等质量的钠和镁分别与足量的稀硫酸反应,放出气体的体积(同温同压)之比为________。
(3)同温同压下,某容器充满CO2重122 g,充满NO气体重115 g,现充满某气体B重123 g,则该气体的相对分子质量为_____。
(4)有15 g A物质和10.5 g B物质恰好完全反应生成7.2 g C物质、1.8 g D物质和0.3 mol E物质,则E物质的摩尔质量是_____g·mol-1。
(5)标准状况下,10 mL N2气体恰好与30 mL H2完全反应生成20 mL气体A,则A的分子式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.56gN2与CO的混合物中原子总数是4NA
B.0.1mol/L的硫酸溶液中含H+的数目为0.2 NA
C.3mol单质Fe完全燃烧转变为Fe3O4,Fe得到8NA个电子
D.标准状况下,22.4LH2O所含的氧原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.将铜片插入稀硝酸中:![]()
B.稀硫酸与Ba(OH)2溶液反应:![]()
C.向A12(SO4)3溶液中加入过量氨水:![]()
D.向Na2SiO3溶液中滴加醋酸:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇一空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图甲所示,该电池中正极的电极反应式为_____。
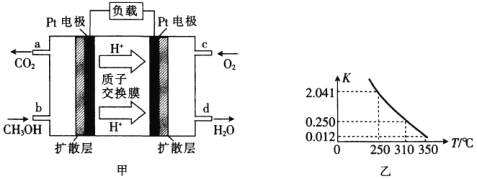
(2)工业上合成甲醇一般采用下列反应:![]() ,
,![]() ,图乙是该反应在不同温度下的化学平衡常数(K):
,图乙是该反应在不同温度下的化学平衡常数(K):
①由图中数据判断a_______0(填“>”“=”或“<”)。
②某温度下,将2molCO和6molH2充入2L的恒容密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol·L-1,则此时的温度为________℃。
(3)T℃时,在恒容密闭容器中发生反应:![]() ,各物质的浓度变化如图丙所示:
,各物质的浓度变化如图丙所示:
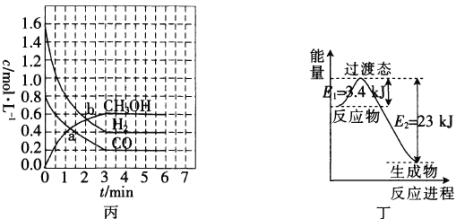
①反应从0min到3min之间,CH3OH的反应速率为________________。
②CO在0~1min和1~3min时平均反应速率[平均反应速率分别以v(0~1),v(1~3)表示]的大小为_____________________________。
(4)目前工业上有一种方法是用CO2和H2在230℃、催化剂条件下转化生成甲醇蒸气和水蒸气。图丁表示恒压容器中0.5molCO2和1.5molH2反应时转化率达80%的能量变化示意图。写出该反应的热化学方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:(8分钟时A为0.2mol 、B为0.5mol)
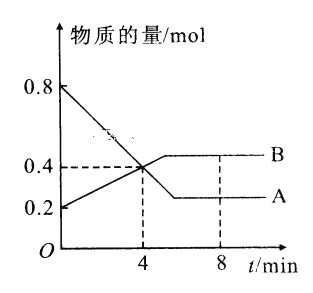
(1)该反应的化学方程式为_________________________。
(2)反应开始时至4min时,A的平均反应速率为________。
(3)4min时,反应是否达平衡状态?________(填“是”或“否”), 8min时,V正________V逆(填“>”“<”或“=”)。
II.在2L密闭容器中,800℃时反应2NO(g)+O2(g) →2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。
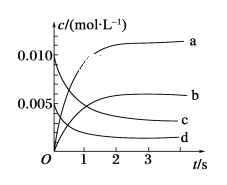
(3)能说明该反应已达到平衡状态的是________(填序号)。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c. v逆(NO)=2v正(O2) d. 容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物的转化关系:C![]() CO2
CO2![]() H2CO3
H2CO3![]() CaCO3
CaCO3![]() CO2,其中涉及的基本反应类型依次是( )。
CO2,其中涉及的基本反应类型依次是( )。
A.化合、置换、分解、复分解
B.置换、复分解、化合、分解
C.置换、化合、复分解、分解
D.置换、化合、分解、复分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com