
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.56gN2与CO的混合物中原子总数是4NA
B.0.1mol/L的硫酸溶液中含H+的数目为0.2 NA
C.3mol单质Fe完全燃烧转变为Fe3O4,Fe得到8NA个电子
D.标准状况下,22.4LH2O所含的氧原子数目为NA
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】2019年是元素周期表诞生150周年,目前周期表七个周期均已排满,共118种元素。短周期元素W、X、Y、Z在周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。
下列说法不正确的是
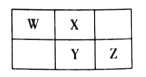
A. 最高价氧化物对应水化物的酸性:Z>Y
B. W的氢化物与Z的氢化物反应,产物的水溶液呈碱性
C. 在元素周期表中,117号元素与Z元素位于同一主族
D. 工业上常用YX2漂白纸浆、毛、丝等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
具有抗菌作用的白头翁衍生物H的合成路线如图所示:
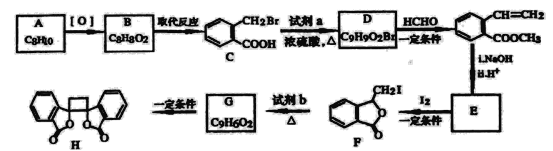
已知:
Ⅰ:R′CH2Br![]() R′HC=CH-R
R′HC=CH-R
Ⅱ: ![]()
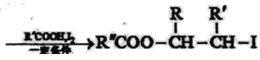
(1)A属于芳香烃,其名称是___________。
(2)写出符合下列条件的B的一种同分异构体:①苯环上只有一个取代基,②能发生银镜反应,③能发生水解反应,该物质的结构简式为___________。
(3)由C生成D的化学方程式是___________。
(4)由G生成H的反应类型是_________,1mol F与足量NaOH溶液反应,消耗__________mol NaOH。
(5)试剂b是_________。
(6)下列说法正确的是________(选填宇母序号)
a G存在顺反异构体
b l mol G最多可以与1mol H2发生加成反应
c l mol H与足量NaOH溶液反应,消耗2mol NaOH
(7)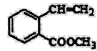 满足下面条件的同分异构体共有________种。
满足下面条件的同分异构体共有________种。
①含有苯环 ②含有2个-CHO ③苯环上有两个取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)![]() D(g)+E(g)△H=QkJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g)△H=QkJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的物质的量如表:
物质的量(mol) 时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T℃时,该反应的平衡常数K=___________。
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是______(填字母编号)。
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2mol B、0.1molD、0.1mol E
(3)对于该反应,用各物质的反应速率与时间的关系曲线表示如下,示意图中的___________(填序号)正确。
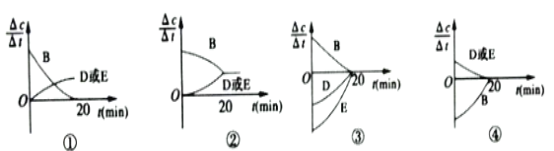
(4)容器的体积和温度T1℃不变,向该容器中加入1.60molB、0.20molD、0.20molE和0.4molA,达到平衡后,与表格中20分钟时各物质的浓度完全相同,投入固体A的物质的量n的取值范围是___________。
(5)若该密闭容器绝热,实验测得B的转化率随温度变化如图所示。由图可知,Q_________0(填“大于”或“小于),c点v正__________v逆(填“大于”、“小于”或“等于”)。
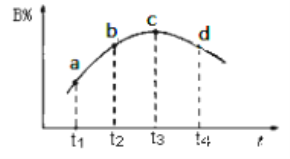
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①6.72 L NH3(标准状况下) ②1.204×1023个H2S分子 ③5.6 g CH4 ④0.5 mol HCl,下列关系正确的是( )
A.体积大小:④>③>②>①B.原子数目:③>①>④>②
C.密度大小:④>②>③>①D.质量大小:④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
(1)若12.4 g Na2X中含有0.4 mol钠离子,Na2X的摩尔质量是________,X的相对原子质量是________。
(2)标准状况,1L 水中通入 aL HCl 气体,忽略盐酸溶液中 HCl的挥发,得到的盐酸溶液密度为 b g/mL,则溶质的物质的量浓度为 __________mol/L
(3)某同学写出以下化学方程式(未配平)NO+HNO3―→N2O3+H2O该应中氧化剂是________(写化学式,下同) ;方程中出现的4种物质中还原性最强的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液至滴定终点,消耗NaOH溶液的体积为Vx、Vy,则

A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铵是一种常见的化肥,某工厂用石膏、NH3、H2O、CO2制备硫酸铵的工艺流程如下:
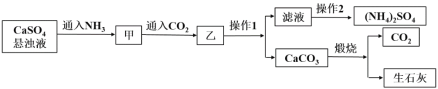
下列说法不正确的是
A. 操作1为过滤,操作2为蒸馏
B. 滤液中的主要阳离子可通过向少量滤液中加NaOH溶液,加热,并用湿润的红色石蕊试纸来检验
C. 甲到乙反应的离子方程式为CaSO4+2NH3+CO2+H2O==CaCO3↓+2NH4++ SO42-
D. 工艺流程中产生的CO2可循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M、R六种短周期元素,周期表中位置如下:
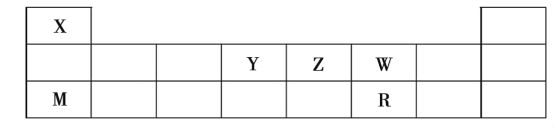
试回答下列问题:
(1)X、Z、W、R四种元素的原子半径由大到小的排列顺序是______(用元素符号表示)。
(2)由X、Z、W、R四种元素中的三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为_____________________________。
(3)由X、W、M、R四种元素组成的一种离子化合物A,已知A既能与盐酸反应,又能与氯水反应,写出A与足量盐酸反应的离子方程式_________________________________。
(4)分子式为X2Y2W4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,其原因是____________________(用方程式及必要的文字说明)。0.1mol·L-1该溶液中各离子浓度由大到小的顺序为________________________。
(5)由X、Z、W、R和Fe五种元素可组成类似明矾的化合物T(相对分子质量为392),1molT中含有6mol结晶水。对化合物T进行如下实验:
a.取T的溶液,加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体。白色沉淀迅速变为灰绿色,最终变为红褐色;
b.另取T的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
则T的化学式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com