
【题目】已知:①6.72 L NH3(标准状况下) ②1.204×1023个H2S分子 ③5.6 g CH4 ④0.5 mol HCl,下列关系正确的是( )
A.体积大小:④>③>②>①B.原子数目:③>①>④>②
C.密度大小:④>②>③>①D.质量大小:④>③>②>①
【答案】B
【解析】
①标准状况下6.72 L NH3的物质的量为![]() =0.3mol,②1.204×1023个H2S分子的物质的量为
=0.3mol,②1.204×1023个H2S分子的物质的量为![]() =0.2mol,③5.6 g CH4的物质的量为
=0.2mol,③5.6 g CH4的物质的量为![]() =0.4mol,④0.5 mol HCl的物质的量为0.5mol,物质的量大小顺序为④>③>①>②。
=0.4mol,④0.5 mol HCl的物质的量为0.5mol,物质的量大小顺序为④>③>①>②。
A项、相同条件下,体积之比等于物质的量之比,物质的量大小顺序为④>③>①>②,则体积大小为④>③>①>②,故A正确;
B项、NH3中原子的物质的量为0.3mol×4=1.2mol,H2S含有的原子的物质的量为0.2mol×3=0.6mol,CH4含有的原子的物质的量为0.4mol×5=2mol,HCl含有的原子的物质的量为0.5mol×2=1mol,原子数目之比等于物质的量之比,则原子数目大小为③>①>④>②,故B正确;
C项、同温同压下,密度之比等于相对分子质量之比,NH3相对分子质量为17,H2S相对分子质量为34,CH4相对分子质量为16,HCl相对分子质量为36.5,故密度大小为④>②>①>③,故C错误;
D项、NH3质量为17g/mol×0.3mol=5.1g,H2S质量为34g/mol×0.2mol=6.8g,CH4量为16g/mol×0.4mol=6.4g,HCl质量为36.5g/mol×0.5mol=18.25g,故质量大小为④>②>③>①,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述一定正确的是( )


A. 图1表示合成氨(放热反应),温度T1和T2对应的平衡常数为K1、K2,则T1<T2,K1>K2
B. 图2所示,反应:X(g)+2Y(g)![]() 3Z(g),b的温度比a高
3Z(g),b的温度比a高
C. 图3表明,该温度下,加入FeCl3不可能引起由b向a的变化
D. 图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MaO。某学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。

已知:溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨其饱和溶液中c(OH-)约为1×10-3mol·L-1。
(1)写出A与氢氧化钠溶液反应的离子方程式:______________________________。
(2)上述流程中两次使用试剂①,推测试剂①应该是____________(填字母)
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)H中溶质是______________。(填化学式)
(4)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是______________ 。
(4)计算溶液F中c(Mg2+)=______________ (25℃时,氢氧化镁的Ksp=5.6×10-12)
II.某化学兴趣小组用下图所示装置进行电化学原理的实验探究。
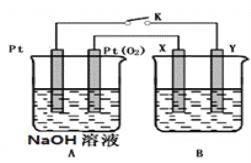
(1)A装置为乙醇燃料电池,若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为________________________。
(2)若B电池的电解质溶液为500mL1.0mol/L的NaCl溶液,X、Y皆为惰性电极,当电池工作一段时间断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变)此时B电池溶液的pH=____________,要是该溶液恢复到原来的状态,需加入____________(填物质并注明物质的量)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海洋资源获得的部分物质如下图所示,有关说法正确的是
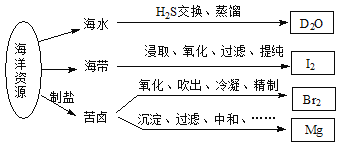
A. 在化学反应中,![]() H2O可转变为D2O
H2O可转变为D2O
B. “加碘食盐”生产中碘添加剂为单质I2
C. 实验室用带玻璃塞的棕色瓶贮存液Br2
D. 电解饱和MgCl2溶液时在阴极得到Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.56gN2与CO的混合物中原子总数是4NA
B.0.1mol/L的硫酸溶液中含H+的数目为0.2 NA
C.3mol单质Fe完全燃烧转变为Fe3O4,Fe得到8NA个电子
D.标准状况下,22.4LH2O所含的氧原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法不正确的是
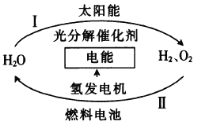
A.过程I中太阳能转化为化学能
B.过程II中化学能转化为电能
C.2molH2与1molO2的能量之和小于2mol H2O的能量
D.H2O的分解反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以MnO2、KClO3、CaCO3及盐酸等为原料制取KMnO4的步骤如下:
Ⅰ.MnO2的氧化![]()
Ⅱ.CO2的制取![]()
Ⅲ.K2MnO4的歧化及过滤和结晶等
回答下列问题:
(1)实验前称取2.5g KClO3、5.2g KOH、3.0g MnO2并充分混合。氯酸钾需过量,其原因是____________________________;熔融时除了需要酒精灯、三脚架、坩埚钳、细铁棒及铁坩埚外,还需要的硅酸盐质仪器有___________________
(2)为了体现“绿色化学”理念,某同学设计了如图所示的“K2MnO4歧化”实验装置。在大试管中装入块状CaCO3,并关闭K2,向长颈漏斗中加入一定量6mol·L-1的盐酸;向三口烧瓶中加入K2MnO4溶液。
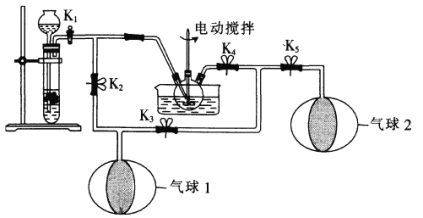
①实验时,不用装置(a)(启普发生器)制取CO2而用装置(b)制取,这是因为______。
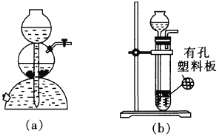
②为了充分利用CO2,实验开始时需关闭____________(填“K1”“K2”“K3”“K4”或“K5”,下同),其余均打开;待“气球1”中收集到足够多的CO2时,关闭______,其余均打开。
③三口烧瓶中物质发生反应生成KMnO4的同时还会生成MnO2和K2CO3,该反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:
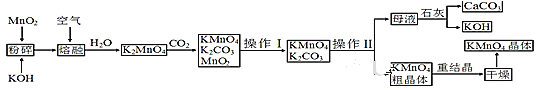
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列___物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.“84”消毒液(NaClO溶液)
(2)粉碎的目的是___;操作Ⅰ的名称是___;操作Ⅱ是根据KMnO4和K2CO3两物质在___(填性质)上差异,采用___(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
(3)上述流程中可以循环使用的物质有石灰、CO2、___和___(写化学式)。
(4)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是___。
(5)铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com