
【题目】为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法不正确的是
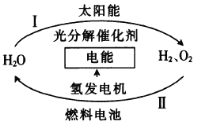
A.过程I中太阳能转化为化学能
B.过程II中化学能转化为电能
C.2molH2与1molO2的能量之和小于2mol H2O的能量
D.H2O的分解反应是吸热反应
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
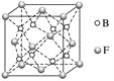
【题目】已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B,C、D与E分别位于同一周期。A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子外围电子排布式:_______________________________。F的离子电子排布式:__________。
(2)写出X涉及化工生产中的一个化学方程式:______________________。
(3)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:_____________。
(4)CE、FA的晶格能分别为786 kJ·mol-1、3 401 kJ·mol-1,试分析导致两者晶格能差异的主要原因是___________________________。
(5)F与B可形成离子化合物,其晶胞结构如图所示。F与B形成的离子化合物的化学式为________________;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是____________________(只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷(C3H8)熔融盐燃料电池和锌蓄电池均为用途广泛的直流电源,放电时二者的总反应分别为C3H8+5O2=3CO2+4H2O,2Zn+O2=2ZnO。用丙烷(C3H8)燃料电池为锌蓄电池充电的装置如图所示,下列说法不正确的是

A. 物质M为CO2
B. 燃料电池消耗1mo1 O2时,理论上有4 mol OH-透过b膜向P电极移动
C. a膜、b膜均适宜选择阴离子交换膜
D. 该装置中,锌蓄电池的负极反应式为Zn+2OH--2e-=ZnO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①6.72 L NH3(标准状况下) ②1.204×1023个H2S分子 ③5.6 g CH4 ④0.5 mol HCl,下列关系正确的是( )
A.体积大小:④>③>②>①B.原子数目:③>①>④>②
C.密度大小:④>②>③>①D.质量大小:④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)下列物质中,属于电解质的是________,(填序号,下同);能导电的是________。
①H2SO4 ②盐酸 ③氯气 ④硫酸钡 ⑤乙醇 ⑥铜 ⑦熔融的NaCl ⑧蔗糖 ⑨空气 ⑩CO2
II. 按要求回答下列问题
(2)硫酸铝(写出电离方程式)_______________。
(3)CuSO4溶液与Ba(OH)2溶液混合(写出离子方程式)_______。
(4)实验室用高锰酸钾制氧气(写化学反应方程式并用单线桥表示电子转移方向和数目)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液至滴定终点,消耗NaOH溶液的体积为Vx、Vy,则

A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸二氢钾(KH2PO4)在工业、农业、医药及食品等行业均有广泛的应用。利用氟磷灰石(化学式为Ca5P3FO12)制备磷酸二氢钾的工艺流程如图所示(部分流程步骤已省略):
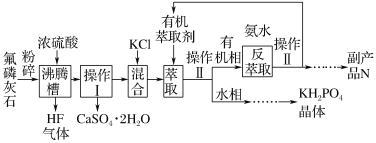
其中,萃取是因为KCl和H3PO4产生的HCl易溶于有机萃取剂。请回答下列问题:
(1)氟磷灰石(Ca5P3FO12)中磷元素的化合价是____。
(2)用化学反应原理解释KCl和H3PO4生成KH2PO4的原因: ________。
(3)沸腾槽不能采用陶瓷材质的原因是_______(用化学方程式表示)。
(4)在得到N的流程中“……”的操作步骤是______、洗涤、干燥。
(5)在萃取过程中,影响萃取率的因素复杂,下图是投料比![]() 对萃取率的影响曲线,在实际操作中,应选择投料比
对萃取率的影响曲线,在实际操作中,应选择投料比![]() 的范围是___(填序号)。
的范围是___(填序号)。
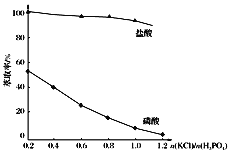
A.0.2~0.4 B.0.4~0.6 C.0.6~0.8 D.0.8~1.0 E.1.0~1.2
(6)电解法制备KH2PO4是用石墨作电极,将电解槽分为a区和b区,中间用阳离子交换膜隔离,a区为3 mol·L-1 H3PO4,b区为3 mol·L-1 KCl。阳极区为____(填“a”或“b”)区,其电极反应式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1molH—H键吸收436kJ能量,断裂1molCl—Cl键吸收243kJ能量,形成1molH-Cl键放出431 kJ能量。H2+Cl2=2HCl的化学反应可用如图表示:
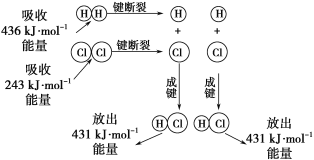
请回答下列有关问题:
(1)反应物断键吸收的总能量为___________________。
(2)生成物成键放出的总能量为______________。
(3)判断H2+Cl2=2HCl反应_____________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”、“=”或“<”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业合成氨的原理是N2(g)+3H2(g)![]() 2NH3(g) △H=-93.0kJ·mol-1
2NH3(g) △H=-93.0kJ·mol-1
(1)已知一定条件下:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) △H=+l 530.0kJ·mol一1。则氢气燃烧热的热化学方程式为___。
4NH3(g)+3O2(g) △H=+l 530.0kJ·mol一1。则氢气燃烧热的热化学方程式为___。
(2)如图,在恒温恒容装置中进行合成氨反应。
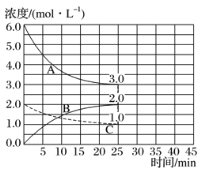
①表示N2浓度变化的曲线是____。
②前25min内,用H2浓度变化表示的化学反应速率是____。
③在25min末刚好平衡,则平衡常数K=____。
(3)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是___。
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩容器,生成更多NH3
(4)电厂烟气脱氮的主反应①:4NH3(g)+6NO(l)![]() 5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)![]() 5N2O(g)+3H2O(g)△H>0。平衡混合气中N2与N2O含量与温度的关系如图。
5N2O(g)+3H2O(g)△H>0。平衡混合气中N2与N2O含量与温度的关系如图。

请回答:在400~600K时,平衡混合气中N2含量随温度的变化规律是___,导致这种规律的原因是___(任答合理的一条原因)。
(5)直接供氨式燃料电池是以NaOH溶液为电解质溶液,电池反应为4NH3(g)+3O2=2N2+6H2O。则负极电极反应式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com