
【题目】已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B,C、D与E分别位于同一周期。A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子外围电子排布式:_______________________________。F的离子电子排布式:__________。
(2)写出X涉及化工生产中的一个化学方程式:______________________。
(3)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:_____________。
(4)CE、FA的晶格能分别为786 kJ·mol-1、3 401 kJ·mol-1,试分析导致两者晶格能差异的主要原因是___________________________。
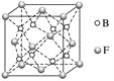
(5)F与B可形成离子化合物,其晶胞结构如图所示。F与B形成的离子化合物的化学式为________________;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是____________________(只要求列出算式)。
【答案】2s22p4 1s22s22p63s23p6 2Al2O3(熔融)![]() 4Al+3O2↑ Al2O3为离子晶体(或者离子化合物),而AlCl3为分子晶体(或者共价化合物) CaO晶体中Ca2+、O2-带的电荷数大于NaCl晶体中Na+、Cl-带的电荷数 CaF2
4Al+3O2↑ Al2O3为离子晶体(或者离子化合物),而AlCl3为分子晶体(或者共价化合物) CaO晶体中Ca2+、O2-带的电荷数大于NaCl晶体中Na+、Cl-带的电荷数 CaF2 ![]()
【解析】
A原子L层上有2对成对电子,说明A是第二周期元素,L层上s轨道有两个成对电子,p轨道上有4个电子,所以A为O;因为A、B位于同一周期,故B也是第二周期元素,又B可形成离子晶体C3DB6,故B为F;又因为C、D与E分别位于同一周期,故前20号元素中C、D与E只能位于第三周期。在C3DB6中,F是负一价,故C只能为正一价,则D是正三价,所以C是Na,D是Al。再结合CE、FA为电子数相同的离子晶体,故E为Cl,F为Ca。据此解答。
(1)由题干分析可知,A为O,F为Ca,所以A元素的基态原子外围电子排布式:2s22p4; F的离子电子排布式:1s22s22p63s23p6;
(2)电解铝工业中常加入冰晶石来降低Al2O3的熔融温度,反应方程式为:2Al2O3(熔融)![]() 4Al+3O2↑;
4Al+3O2↑;
(3)因为Al2O3为离子晶体,熔融状态可导电,而AlCl3为分子晶体,熔融状态不导电,故工业上工业冶炼Al不以AlCl3而是以Al2O3为原料;
(4)因为Ca2+和Cl-电子层结构相同,O2-和Na+电子层结构相同,且Ca2+、O2-带的电荷数大于NaCl晶体中Na+、Cl-,故NaCl晶格能低于CaO晶格能;
(5)从所给晶胞结构示意图可知其中F-全在内部,有8个,Ca2+有![]() ,故形成的离子化合物的化学式为CaF2;CaF2晶体的密度为ag·cm-3,则晶胞的体积是
,故形成的离子化合物的化学式为CaF2;CaF2晶体的密度为ag·cm-3,则晶胞的体积是![]() 。
。


科目:高中化学 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备,下列说法正确的是
SiO2 ![]() Si(粗)
Si(粗) 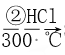 SiHCl3
SiHCl3 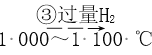 Si(纯)
Si(纯)
A. 步骤①的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
B. 步骤①、②、③中每生成或反应1 mol Si,转移2 mol电子
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2。“气化炉”中主要反应有:
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJmol﹣1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41.2kJmol﹣1
(1)气化炉中CO2与C反应转化为CO,该反应的热化学方程式是___。
(2)用煤炭气合成甲醇的反应为CO(g)+2H2(g)CH3OH(g)。在密闭容器中,将CO和H2按物质的量1:2混合反应,CO的平衡转化率与温度、压强的关系如图所示。
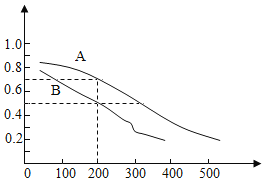
①生成甲醇的反应为___反应(填“放热”或“吸热”)。
②图中两条曲线分别表示压强为0.1MPa和5.0MPa下CO转化率随温度的变化,其中代表压强是5.0MPa的曲线是___(填“A”或“B”)。
③在不改变反应物用量的前提下,为提高CO转化率可采取的措施有___(答出一种即可)。
④压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭的燃料之一是铝粉与高氯酸铵(NH4ClO4)的固体混合物,点燃时,铝粉被氧化。放热引发高氯酸铵反应:2NH4ClO4═N2↑+4H2O+Cl2↑+2O2↑,反应放出大量热。
(1)该反应中被氧化的元素是___和___;
(2)氧化产物与还原产物的质量之比为___;
(3)该反应中若生成标况下2.24LCl2时,电子转移数为___;
(4)若生成的水在高温下也为气态,则混合气体的平均摩尔质量为__g/mol(小数点后保留一位)。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,易溶于水,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
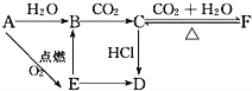
(1)写出A、B、C、D、E、F的化学式:
A.___,B.___,C.___,D.___,E.___,F.___。
(2)写出有关反应的化学方程式(是离子反应的直接写离子方程式)。
A→E:___,
E→B:___,
F→C:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述一定正确的是( )


A. 图1表示合成氨(放热反应),温度T1和T2对应的平衡常数为K1、K2,则T1<T2,K1>K2
B. 图2所示,反应:X(g)+2Y(g)![]() 3Z(g),b的温度比a高
3Z(g),b的温度比a高
C. 图3表明,该温度下,加入FeCl3不可能引起由b向a的变化
D. 图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法不正确的是
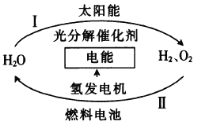
A.过程I中太阳能转化为化学能
B.过程II中化学能转化为电能
C.2molH2与1molO2的能量之和小于2mol H2O的能量
D.H2O的分解反应是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com