
【题目】科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2。“气化炉”中主要反应有:
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJmol﹣1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41.2kJmol﹣1
(1)气化炉中CO2与C反应转化为CO,该反应的热化学方程式是___。
(2)用煤炭气合成甲醇的反应为CO(g)+2H2(g)CH3OH(g)。在密闭容器中,将CO和H2按物质的量1:2混合反应,CO的平衡转化率与温度、压强的关系如图所示。
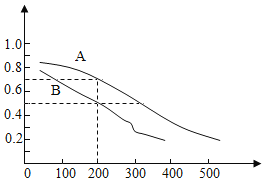
①生成甲醇的反应为___反应(填“放热”或“吸热”)。
②图中两条曲线分别表示压强为0.1MPa和5.0MPa下CO转化率随温度的变化,其中代表压强是5.0MPa的曲线是___(填“A”或“B”)。
③在不改变反应物用量的前提下,为提高CO转化率可采取的措施有___(答出一种即可)。
④压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是___。
【答案】C(s)+CO2(g)=2CO(g) △H=+172.5 kJmol﹣1 放热 A 降温或加压 25%
【解析】
(1)已知:①C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJmol﹣1,②CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41.2kJmol﹣1,利用盖斯定律将①﹣②可得C(s)+CO2(g)=2CO(g)△H=+172.5 kJmol﹣1,故答案为:C(s)+CO2(g)=2CO(g)△H=+172.5 kJmol﹣1;
(2)①由图象可知,随温度的升高其转化率降低,说明升温时平衡逆向移动,正反应放热,故答案为:放热;
②从方程式可知,反应物有3mol气体,生成物有1mol气体,所以压强增大时平衡气体体积减小的方向移动,即正向移动,在相同温度时,转化率高的压强大,故答案为:A;
③增大反应物的转化率,即要使平衡向正向移动,而影响平衡移动的因素只有三个:温度、压强、浓度,本题只能是降温或加压,故答案为:降温或加压;
④根据图像,压强为0.1MPa、温度为200℃时CO的转化率为50%,设加入CO物质的量为amol,则H2为2amol
CO(g)+2H2(g)CH3OH(g)
反应前(mol) a 2a 0
反应了(mol)0.5a a 0.5a
平衡时(mol)0.5a a 0.5a
求得平衡时甲醇的物质的量分数为:![]() ×100%=25%,故答案为:25%。
×100%=25%,故答案为:25%。


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】(1)25℃时,相同物质的量浓度的下列溶液:①NaCl②NaOH③H2SO4④(NH4)2SO4,其中水的电离程度按由大到小顺序排列为___________(填序数)。
(2)在25℃下,将amol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显___________(填“酸”碱”或“中)性;用含a的代数式表示NH3·H2O的电离常数Kb=___________。
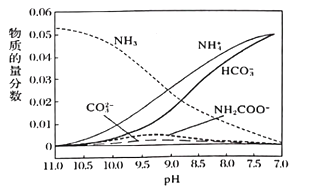
(3)一定温度下,向氨水中通入CO2,得到(NH4)2CO3、NH4HCO3等物质,溶液中各种微粒的物质的量分数与pH的关系如图所示。随着CO2的通入,溶液中c(OH-)/c(NH3·H2O)将___________(填“增大”“减小”或“不变”)。pH=9时,溶液中c(NH4+)+c(H+)=___________。
(4)焦亚硫酸钠(Na2S2O5)可用作食品的抗氧化剂,常用于葡萄酒、果脯等食品中。在测定某葡萄酒中Na2S2O5残留量时,取25.00mL葡萄酒样品,用0.01000mol·L-1的碘标准液滴定至终点,消耗5.00mL。该滴定反应的离子方程式为___________;葡萄酒中的Na2S2O5的使用量是以SO2来计算的,则该样品中Na2S2O5的残留量为___________g·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质,下列说法正确的是
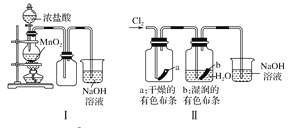
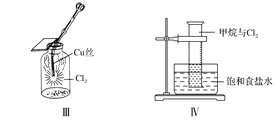
A. Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B. Ⅱ图中:湿润的有色布条能褪色,烧杯NaOH溶液的作用是吸收尾气
C. Ⅲ图中:生成蓝色的烟
D. Ⅳ图中:量筒中发生了加成反应,量筒内液面上升,量筒壁上有无色液滴出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G七种物质的转化关系如图所示(部分反应物、产物和反应条件未标出)。其中,A、B为中学化学常见的金属单质,C是淡黄色固体,D既能与强酸溶液反应,又能与强碱溶液反应,F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀,E和G焰色反应均呈黄色。①、④均为燃烧反应。
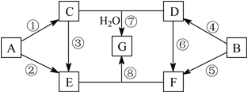
请回答下列问题:
(1)D的化学式____________,G的化学式____________。
(2)按要求写出下列反应的方程式:
③的化学方程式:___________________,
B与E的溶液反应的离子方程式:________________。
(3)将E的溶液逐滴加入到F的溶液中至过量,其现象是_____,总反应的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过卤素间的反应实验,可以比较出卤素单质氧化性的强弱。实验如下:

下列说法不正确的是
A. CCl4起到萃取、富集I2的作用
B. a中下层变无色,说明I2 转化为I-
C. Ⅲ中发生反应的离子方程式为:Br2 + 2I-=== I2 + 2Br-
D. 依据a、b中现象,可以证明Cl2的氧化性比 Br2强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的晶胞结构示意图如图所示,它的化学式是

A. BaTi8O12
B. BaTiO3
C. BaTi2O4
D. BaTi4O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量FeSO4,较多的CuSO4, 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
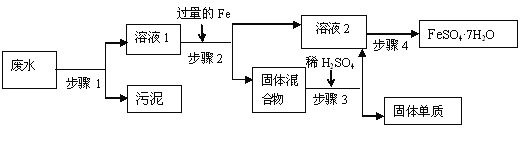
(1)步骤1的主要操作是______,(填操作名称)需用到的玻璃仪器除烧杯外还有_______。
(2)步骤2中发生反应的化学方程式为___________
(3)步骤3中发生反应的化学方程式为_______
(4)步骤4中涉及的操作是:蒸发浓缩、________、过滤、洗涤、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B,C、D与E分别位于同一周期。A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子外围电子排布式:_______________________________。F的离子电子排布式:__________。
(2)写出X涉及化工生产中的一个化学方程式:______________________。
(3)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:_____________。
(4)CE、FA的晶格能分别为786 kJ·mol-1、3 401 kJ·mol-1,试分析导致两者晶格能差异的主要原因是___________________________。
(5)F与B可形成离子化合物,其晶胞结构如图所示。F与B形成的离子化合物的化学式为________________;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是____________________(只要求列出算式)。
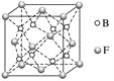
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷(C3H8)熔融盐燃料电池和锌蓄电池均为用途广泛的直流电源,放电时二者的总反应分别为C3H8+5O2=3CO2+4H2O,2Zn+O2=2ZnO。用丙烷(C3H8)燃料电池为锌蓄电池充电的装置如图所示,下列说法不正确的是

A. 物质M为CO2
B. 燃料电池消耗1mo1 O2时,理论上有4 mol OH-透过b膜向P电极移动
C. a膜、b膜均适宜选择阴离子交换膜
D. 该装置中,锌蓄电池的负极反应式为Zn+2OH--2e-=ZnO+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com