
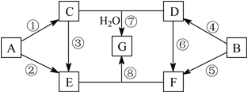
����Ŀ��A��G�������ʵ�ת����ϵ��ͼ��ʾ�����ַ�Ӧ�����ͷ�Ӧ����δ����������У�A��BΪ��ѧ��ѧ�����Ľ������ʣ�C�ǵ���ɫ���壬D������ǿ����Һ��Ӧ��������ǿ����Һ��Ӧ��F��Һ�м���AgNO3��Һ����������ϡ����İ�ɫ������E��G��ɫ��Ӧ���ʻ�ɫ���١��ܾ�Ϊȼ�շ�Ӧ��
��ش��������⣺
(1)D�Ļ�ѧʽ____________��G�Ļ�ѧʽ____________��
(2)��Ҫ��д�����з�Ӧ�ķ���ʽ��
�۵Ļ�ѧ����ʽ��___________________��
B��E����Һ��Ӧ�����ӷ���ʽ��________________��
(3)��E����Һ��μ��뵽F����Һ������������������_____���ܷ�Ӧ�����ӷ���ʽΪ_______��
���𰸡�Al2O3 NaAlO2 2Na2O2��2H2O=4NaOH��O2�� 2Al��2OH-��2H2O=2AlO2-��3H2�� �Ȳ�����ɫ��״���������������ܽ� Al3+��4OH��=AlO2-��2H2O
��������
A����ѧ��ѧ�����Ľ������ʣ�A����ȼ�շ�Ӧ����C��C�ǵ���ɫ���壬CΪNa2O2��AΪNa��BΪ��ѧ��ѧ�����Ľ������ʣ�B����ȼ�շ�Ӧ����D��D������ǿ����Һ��Ӧ��������ǿ����Һ��Ӧ��DΪAl2O3��BΪAl��C+D+H2O��G��G����ɫ��Ӧ�ʻ�ɫ��GΪNaAlO2��A��E��C��E�Լ�E����ɫ��Ӧ�ʻ�ɫ��E�к�NaԪ�أ�F��Һ�м���AgNO3��Һ����������ϡ����İ�ɫ������F��Һ�к�Cl-�����D��F��E+F��G����EΪNaOH��FΪAlCl3��
A����ѧ��ѧ�����Ľ������ʣ�A����ȼ�շ�Ӧ����C��C�ǵ���ɫ���壬CΪNa2O2��AΪNa��BΪ��ѧ��ѧ�����Ľ������ʣ�B����ȼ�շ�Ӧ����D��D������ǿ����Һ��Ӧ��������ǿ����Һ��Ӧ��DΪAl2O3��BΪAl��C+D+H2O��G��G����ɫ��Ӧ�ʻ�ɫ��GΪNaAlO2��A��E��C��E�Լ�E����ɫ��Ӧ�ʻ�ɫ��E�к�NaԪ�أ�F��Һ�м���AgNO3��Һ����������ϡ����İ�ɫ������F��Һ�к�Cl-�����D��F��E+F��G����EΪNaOH��FΪAlCl3��
��1�������Ϸ�����֪D�Ļ�ѧʽΪAl2O3��G�Ļ�ѧʽΪNaAlO2��
�ʴ�Ϊ��Al2O3��NaAlO2��
��2���۵Ļ�ѧ����ʽ��2Na2O2��2H2O=4NaOH��O2��
B��E����Һ��Ӧ�����ӷ���ʽ��2Al��2OH-��2H2O=2AlO2-��3H2��
�ʴ�Ϊ��2Na2O2��2H2O=4NaOH��O2����2Al��2OH-��2H2O=2AlO2-��3H2����
��3��EΪNaOH��FΪAlCl3����E����Һ��μ��뵽F����Һ���������������ķ�Ӧ����ΪAl3++3OH-=Al(OH)3��Al(OH)3+OH-=AlO2-+2H2O���������Ȳ�����ɫ��״���������������ܽ⣬�ܷ�Ӧ���ӷ���ʽΪAl3+��4OH��=AlO2-��2H2O��
�ʴ�Ϊ���Ȳ�����ɫ��״���������������ܽ⣻Al3+��4OH��=AlO2-��2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D֮���ת����ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��

A.��AΪFe��CΪ��������Bһ������
B.��AΪH2O��B��DΪ�������Cһ�������嵥��
C.��CΪ���ʣ�DΪ�������A��B��һ����һ�������ǵ���
D.��DΪ���ʣ�A��BΪ������÷�Ӧһ������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ߴ��ȵ������ǵ��͵����ǽ������ϣ��ֳơ��뵼�塱���ϣ����ķ��ֺ�ʹ��������������һ���������������ֲ��Ͽ������з����Ʊ�������˵����ȷ����
SiO2 ![]() Si(��)
Si(��) 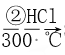 SiHCl3
SiHCl3 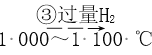 Si(��)
Si(��)
A. ����ٵĻ�ѧ����ʽΪSiO2��C![]() Si��CO2��
Si��CO2��
B. ����١��ڡ�����ÿ���ɻ�Ӧ1 mol Si��ת��2 mol����
C. ����������������ᷴӦ�����費��������ᷴӦ
D. SiHCl3(�е�33.0 ��)�к���������SiCl4(�е�67.6 ��)��ͨ��������ᴿSiHCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3.48g������������ȫ�ܽ���100mL 1mol/L�������У�Ȼ�����K2Cr2O7��Һ25 mLǡ��ʹ��Һ�е�Fe2+ȫ��ת��ΪFe3+��Cr2O72-ȫ��ת��ΪCr3+����K2Cr2O7��Һ�����ʵ���Ũ���ǣ� ��
A. 0.05mol/L B. 0.2 mol/L C. 0.1 mol/L D. 0.3 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������A������ͼ��������Է�������Ϊ84��������ױ��������к���̼̼˫�����˴Ź������ױ���������ֻ��һ�����͵��⡣
(1)A�Ľṹ��ʽΪ_______��
(2)A�е�̼ԭ���Ƿ���ͬһƽ�棿________(��ǡ����ǡ�)��
(3)����ͼ�У�D1��D2��Ϊͬ���칹�壬E1��E2��Ϊͬ���칹�塣
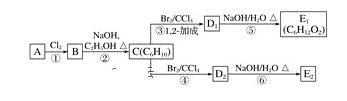
C�Ļ�ѧ������_____����Ӧ�ݵĻ�ѧ����ʽΪ_________________��E2�Ľṹ��ʽ��_____���ܵķ�Ӧ������______���ķ�Ӧ������_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100 mL H2SO4��CuSO4�Ļ��Һ�У���ʯī���缫���е�⣬�����Ͼ��ռ���2.24 L����(��״����)����ԭ���Һ��Cu2�������ʵ���Ũ��Ϊ(����)
A. 1 mol��L��1 B. 2 mol��L��1 C. 3 mol��L��1 D. 4 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ҿ�����һ�֡��ྻú��������ͨ�������ú�㡰����¯���н�����������ˮ�����ķ�����������������ֵ��ú̿��������Ҫ�ɷ���CO��H2��������¯������Ҫ��Ӧ�У�
C��s��+H2O��g����CO��g��+H2��g����H��+131.3kJmol��1
CO��g��+H2O��g����CO2��g��+H2��g����H����41.2kJmol��1
��1������¯��CO2��C��Ӧת��ΪCO���÷�Ӧ���Ȼ�ѧ����ʽ��___��
��2����ú̿���ϳɼ״��ķ�ӦΪCO��g��+2H2��g��CH3OH��g�������ܱ������У���CO��H2�����ʵ���1��2��Ϸ�Ӧ��CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
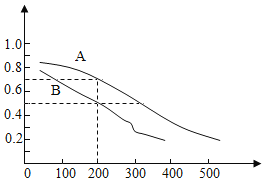
�����ɼ״��ķ�ӦΪ___��Ӧ������ȡ������ȡ�����
��ͼ���������߷ֱ��ʾѹǿΪ0.1MPa��5.0MPa��COת�������¶ȵı仯�����д���ѹǿ��5.0MPa��������___���A����B������
���ڲ��ı䷴Ӧ��������ǰ���£�Ϊ���COת���ʿɲ�ȡ�Ĵ�ʩ��___�����һ�ּ��ɣ���
��ѹǿΪ0.1MPa���¶�Ϊ200��ʱ��ƽ�������м״������ʵ���������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2���ǻ��춡������������ˮ����һ��Ӧ�����л��ϳɺ�ҩ������Ļ���ԭ�ϡ�

��1��2���ǻ��춡�������ķ���ʽΪ_________����ͬ��ѧ���������ں˴Ź�������ͼ���в�ͬ�����շ壬��2���ǻ��춡��������_________�����շ壻
��2���٢ڵķ�Ӧ���ͷֱ�Ϊ_________��_________��
��3����֪IΪ�������I��B�Ļ�ѧ����ʽΪ_________��
��4�����۲���F�Ľṹ��ʽΪ_________��
��5�������![]() ��
�� ��˵����ȷ����_________��˫ѡ������ĸ����
��˵����ȷ����_________��˫ѡ������ĸ����
A����������FeCl3��Һ����ɫ����ǰ�߲���
B�����߶�������NaHCO3��Һ��Ӧ�ų�CO2
C�����߶�����������������Һ������Ӧ�����������ʵ������ʱ�������������Ƶ��������
D�����߶����������������ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ������һ����ȷ����(����)


A. ͼ1��ʾ�ϳɰ�(���ȷ�Ӧ),�¶�T1��T2��Ӧ��ƽ�ⳣ��ΪK1��K2,��T1<T2,K1>K2
B. ͼ2��ʾ,��Ӧ:X(g)+2Y(g)![]() 3Z(g),b���¶ȱ�a��
3Z(g),b���¶ȱ�a��
C. ͼ3����,���¶���,����FeCl3������������b��a�ı仯
D. ͼ4��ʾ,��ˮϡ��pH��ͬ������ʹ���,����ʾ����,����ʾ����,����Һ������:c>b>a
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com