
����Ŀ����֪ij��ҵ��ˮ�к��д���FeSO4���϶��CuSO4�� �Լ��������࣬ͨ���������̿ɴӸ÷�ˮ�л���FeSO4��7H2O���弰����Cu��
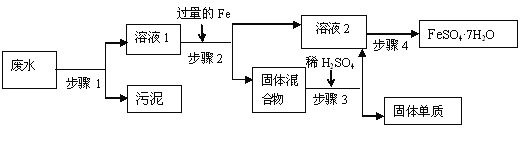
(1)����1����Ҫ������______������������ƣ����õ��IJ����������ձ����_______��
(2)����2�з�����Ӧ�Ļ�ѧ����ʽΪ___________
(3)����3�з�����Ӧ����ѧ����ʽΪ_______
(4)����4���漰�IJ����ǣ�����Ũ����________�����ˡ�ϴ�ӡ���ɡ�
���𰸡����� ��ͨ©��(��©��)�������� Fe+CuSO4=FeSO4+Cu Fe+H2SO4=FeSO4+H2�� ��ȴ�ᾧ��ᾧ
��������
(1)���ݹ��˿��Խ������Թ������Һ�з��������������Ҫ�IJ����������ձ�����������©�����з�����
(2)���ݹ�ҵ��ˮ�к��д���FeSO4�϶��CuSO4����������ͭ��Ӧ��������������ͭ���з�����
(3)���ݲ���2�м�������ǹ����ģ����������к�������ͭ���������ᷴӦ��������������������
(4)���ݹ�ҵ��ˮ�к������������������ʵ��ܽ�����¶ȵ�Ӱ��仯�ϴ��ýᾧ����������
(1)����1�Ǵӷ�ˮ�з��������Թ����Һ̬���ʵķ������ò���Ϊ���ˣ�������Ҫ�IJ����������ձ��⣬����Ҫ©���Ͳ�������
(2)����2����ҵ��ˮ�м�����������ۣ����ڷ�ˮ�к��д���FeSO4�ͽ϶��CuSO4����������ͭ��Ӧ��������������ͭ����ѧ����ʽΪ��Fe+CuSO4=FeSO4+Cu��
(3)���ڲ���2�м�������ǹ����ģ����Թ��������к�������ͭ���������ᷴӦ����������������������ѧ����ʽΪ��Fe+H2SO4=FeSO4+H2����
(4)��ˮ�к������������������ʵ��ܽ�����¶ȵ�Ӱ��仯�ϴ���Һ����Ũ����õ��䱥����Һ��Ȼ���½ᾧ�ͻ�������������塣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ����Ȼ���еĵ�ˮ�������������������ˡ������ȹ��մ�����õ��ġ����õ�����ˮ�������ж������ȣ�ClO2��������أ�K2FeO4���ȡ�
��1��ij�о�С������ͼװ���Ʊ�����ClO2���г�װ������ȥ����
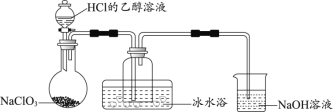
���ϣ�ClO2������Ϊ������ˮ������ˮ��Ӧ�����壬ˮ��Һ�������ɫ��11��ʱҺ���ɺ���ɫҺ�塣��NaClO3��HCl���Ҵ���ҺΪԭ���Ʊ�ClO2�ķ�ӦΪ2NaClO3 + 4HCl= 2ClO2��+ Cl2��+ 2NaCl + 2H2O��
�ٱ�ˮԡ��������____________��
�� NaOH��Һ�з�������Ҫ��Ӧ�����ӷ���ʽΪ________________��
��2����ClO2ˮ��Һ�μӵ�KI��Һ�У���Һ���ػƣ��������м�������CCl4�������ã��۲쵽____��֤��ClO2���������ԡ�
��3��ClO2��ɱ�����������л�����������������Σ�ClO2-�����轫��ת��ΪCl-��ȥ�������Լ��У��ɽ�ClO2-ת��ΪCl-����_____________________������ĸ��ţ���
a. FeSO4 b. O3 c. KMnO4 d. SO2
��4��K2FeO4��һ�����͡���ɫ�Ķ�ܾ�ˮ�������������������������������������������ɫ������������Ϊһ�塣ʵ�����Ʊ�K2FeO4�ķ������£��ڱ�ˮԡ�У���KClO��KOH�Ļ����Һ��������μ����������������Ͻ��衣
�������Ʊ�K2FeO4��Ӧ�����ӷ���ʽΪ______________________��
�ھ�ˮ�����У�K2FeO4���������������õ�ԭ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������A������ͼ��������Է�������Ϊ84��������ױ��������к���̼̼˫�����˴Ź������ױ���������ֻ��һ�����͵��⡣
(1)A�Ľṹ��ʽΪ_______��
(2)A�е�̼ԭ���Ƿ���ͬһƽ�棿________(��ǡ����ǡ�)��
(3)����ͼ�У�D1��D2��Ϊͬ���칹�壬E1��E2��Ϊͬ���칹�塣
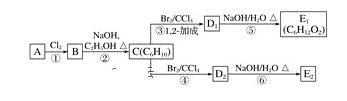
C�Ļ�ѧ������_____����Ӧ�ݵĻ�ѧ����ʽΪ_________________��E2�Ľṹ��ʽ��_____���ܵķ�Ӧ������______���ķ�Ӧ������_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ҿ�����һ�֡��ྻú��������ͨ�������ú�㡰����¯���н�����������ˮ�����ķ�����������������ֵ��ú̿��������Ҫ�ɷ���CO��H2��������¯������Ҫ��Ӧ�У�
C��s��+H2O��g����CO��g��+H2��g����H��+131.3kJmol��1
CO��g��+H2O��g����CO2��g��+H2��g����H����41.2kJmol��1
��1������¯��CO2��C��Ӧת��ΪCO���÷�Ӧ���Ȼ�ѧ����ʽ��___��
��2����ú̿���ϳɼ״��ķ�ӦΪCO��g��+2H2��g��CH3OH��g�������ܱ������У���CO��H2�����ʵ���1��2��Ϸ�Ӧ��CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
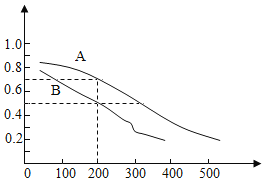
�����ɼ״��ķ�ӦΪ___��Ӧ������ȡ������ȡ�����
��ͼ���������߷ֱ��ʾѹǿΪ0.1MPa��5.0MPa��COת�������¶ȵı仯�����д���ѹǿ��5.0MPa��������___���A����B������
���ڲ��ı䷴Ӧ��������ǰ���£�Ϊ���COת���ʿɲ�ȡ�Ĵ�ʩ��___�����һ�ּ��ɣ���
��ѹǿΪ0.1MPa���¶�Ϊ200��ʱ��ƽ�������м״������ʵ���������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ļ�ѧ��Դ���⣬�Ӻ�ˮ�п���ȡ�ȡ��塢�⼰�仯����Ʒ��
��1���ȵ�ԭ�ӽṹʾ��ͼ��___��
��2������Ԫ�����ڱ��е�λ����___��
��3����Ũ���ĺ�ˮ��ͨ��Cl2���ɽ�Br��ת��ΪBr2���÷�Ӧ�����ӷ���ʽ��___��
��4�����ȿ��������������в�����Br2����������ŨNa2CO3��Һ���գ�����NaBr��NaBrO3�ȣ��ٽ������Һ��ϡ�����ữ�õ�Br2���õ�Br2�����ӷ���ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2���ǻ��춡������������ˮ����һ��Ӧ�����л��ϳɺ�ҩ������Ļ���ԭ�ϡ�

��1��2���ǻ��춡�������ķ���ʽΪ_________����ͬ��ѧ���������ں˴Ź�������ͼ���в�ͬ�����շ壬��2���ǻ��춡��������_________�����շ壻
��2���٢ڵķ�Ӧ���ͷֱ�Ϊ_________��_________��
��3����֪IΪ�������I��B�Ļ�ѧ����ʽΪ_________��
��4�����۲���F�Ľṹ��ʽΪ_________��
��5�������![]() ��
�� ��˵����ȷ����_________��˫ѡ������ĸ����
��˵����ȷ����_________��˫ѡ������ĸ����
A����������FeCl3��Һ����ɫ����ǰ�߲���
B�����߶�������NaHCO3��Һ��Ӧ�ų�CO2
C�����߶�����������������Һ������Ӧ�����������ʵ������ʱ�������������Ƶ��������
D�����߶����������������ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����˽̰�̲�ʵ�顰��200mL�ձ��з���20g���ǣ�C12H22O11������������ˮ��������ȣ�Ȼ���ټ���15mL��������Ϊ98%Ũ���ᣬѸ�ٽ��衱��������̽����
��1���۲����������ȱ�ƣ�����ڣ�������ͣ��γ����ɶ�ĺ���״��ɫ���ʣ�ͬʱ�ŵ��̼�����ζ����ѹ�˺�ɫ����ʱ���о���Ӳ������ˮ�г�Ư��״̬��ͬѧ�������������Ʋ�����н��ۣ�
��Ũ�������ǿ������ ��Ũ���������ˮ�� ��Ũ���������ˮ�Ԣ�Ũ����������� �ݺ�ɫ���ʾ���ǿ������
�������ݲ���ֵ���_________������ţ���
��2��Ϊ����֤������Ũ���ᷴӦ���ɵ���̬���ͬѧ�����������װ�ã�

�Իش��������⣺
��ͼ1��A�����ѡ������װ��_________�����ţ���
��ͼ1�� Bװ����װ�Լ���_________��Dװ�����Լ���������_________��Eװ���з�����������_________��
��ͼ1��Aװ����ʹ�����ȱ�ڵĻ�ѧ��Ӧ����ʽΪ_________����������͵Ļ�ѧ����ʽΪ��_________��
��ijѧ����ͼ2����ʵ��ʱ������DƿƷ�첻��ɫ��Eװ�����������ݳ���Fװ�������Ը��������Һ��ɫ��dz���Ʋ�Fװ�������Ը��������Һ��ɫ��dz��ԭ��_________���䷴Ӧ�����ӷ���ʽ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F�������������±仯��ϵ��E�ǵ���ɫ��ĩ���жϣ�
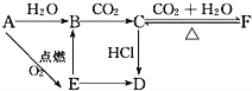
��1��д��A��B��C��D��E��F�Ļ�ѧʽ��
A��___��B��___��C��___��D��___��E��___��F��___��
��2��д���йط�Ӧ�Ļ�ѧ����ʽ�������ӷ�Ӧ��ֱ��д���ӷ���ʽ����
A��E��___��
E��B��___��
F��C��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ú�����Դ��õIJ�����������ͼ��ʾ���й�˵����ȷ����
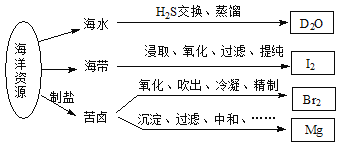
A. �ڻ�ѧ��Ӧ�У�![]() H2O��ת��ΪD2O
H2O��ת��ΪD2O
B. ���ӵ�ʳ���������е����Ӽ�Ϊ����I2
C. ʵ�����ô�����������ɫƿ����ҺBr2
D. ��ⱥ��MgCl2��Һʱ�������õ�Mg
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com