
【题目】[化学——选修5:有机化学基础]
具有抗菌作用的白头翁衍生物H的合成路线如图所示:
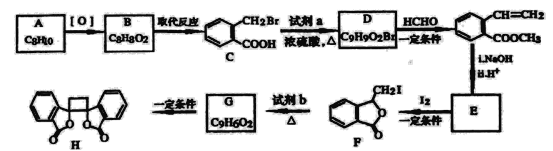
已知:
Ⅰ:R′CH2Br![]() R′HC=CH-R
R′HC=CH-R
Ⅱ: ![]()
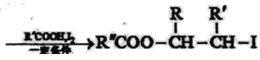
(1)A属于芳香烃,其名称是___________。
(2)写出符合下列条件的B的一种同分异构体:①苯环上只有一个取代基,②能发生银镜反应,③能发生水解反应,该物质的结构简式为___________。
(3)由C生成D的化学方程式是___________。
(4)由G生成H的反应类型是_________,1mol F与足量NaOH溶液反应,消耗__________mol NaOH。
(5)试剂b是_________。
(6)下列说法正确的是________(选填宇母序号)
a G存在顺反异构体
b l mol G最多可以与1mol H2发生加成反应
c l mol H与足量NaOH溶液反应,消耗2mol NaOH
(7) 满足下面条件的同分异构体共有________种。
满足下面条件的同分异构体共有________种。
①含有苯环 ②含有2个-CHO ③苯环上有两个取代基
【答案】1,2-二甲苯(邻二甲苯) 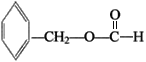
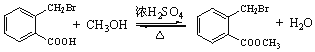 加成反应 2 NaOH醇溶液 c 12种
加成反应 2 NaOH醇溶液 c 12种
【解析】
由A的分子式、C的结构简式,可知芳香烃A为![]() ,结合B的分子式与C的结构,可知B为
,结合B的分子式与C的结构,可知B为![]() ,B与液溴在光照条件下反应得到C.由D的分子式、D后产物结构,结合信息i,可推知D为
,B与液溴在光照条件下反应得到C.由D的分子式、D后产物结构,结合信息i,可推知D为![]() ,则C与甲醇发生酯化反应生成D,故试剂a为CH3OH.D后产物发生酯的碱性水解、酸化得到E为
,则C与甲醇发生酯化反应生成D,故试剂a为CH3OH.D后产物发生酯的碱性水解、酸化得到E为![]() .由H的结构,结合信息ii可知F为
.由H的结构,结合信息ii可知F为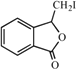 ,F发生消去反应生成G为
,F发生消去反应生成G为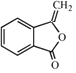 ,G发生加成反应得到H。
,G发生加成反应得到H。
(1)A是![]() ,其名称是:邻二甲苯。
,其名称是:邻二甲苯。
(2)①苯环上只有一个取代基,②能发生银镜反应,含有醛基,③能发生水解反应,含有酯基,是甲酸酯,符合上列条件的B的一种同分异构体: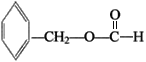 ;
;
(3)由C生成D的化学方程式是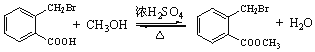 。
。
(4)G含有碳碳双键,由G生成H的反应是加成反应,F为 ,含有酯基和I原子,水解生成的羧基和HI可与NaOH溶液反应,1mol F与足量NaOH溶液反应,消耗2mol NaOH。
,含有酯基和I原子,水解生成的羧基和HI可与NaOH溶液反应,1mol F与足量NaOH溶液反应,消耗2mol NaOH。
(5)试剂b是NaOH醇溶液,F发生消去反应生成G为 。
。
(6)a.G为 ,不存在顺反异构体,故a错误;
,不存在顺反异构体,故a错误;
b.1mol G最多可以与4mol H2发生加成反应,故b错误;
c.1mol H含有两摩尔酯基,与足量NaOH溶液反应,消耗2molNaOH,故c正确。
(7)①含有苯环 ②含有2个-CHO ③苯环上有两个取代基分为四种情况,-CHO和-CH2CH2CHO、-CHO和-CH(CH3)CHO、两个-CH2CHO、-CH3和-CH(CHO)2,每种情况两个原子团在苯环上分布均有邻、间、对,三种情况,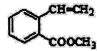 满足下面条件的同分异构体共有4×3=12种。
满足下面条件的同分异构体共有4×3=12种。


科目:高中化学 来源: 题型:
【题目】在100 mL H2SO4和CuSO4的混合液中,用石墨作电极进行电解,两极上均收集到2.24 L气体(标准状况下),则原混合液中Cu2+的物质的量浓度为( )
A. 1 mol·L-1 B. 2 mol·L-1 C. 3 mol·L-1 D. 4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭的燃料之一是铝粉与高氯酸铵(NH4ClO4)的固体混合物,点燃时,铝粉被氧化。放热引发高氯酸铵反应:2NH4ClO4═N2↑+4H2O+Cl2↑+2O2↑,反应放出大量热。
(1)该反应中被氧化的元素是___和___;
(2)氧化产物与还原产物的质量之比为___;
(3)该反应中若生成标况下2.24LCl2时,电子转移数为___;
(4)若生成的水在高温下也为气态,则混合气体的平均摩尔质量为__g/mol(小数点后保留一位)。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,易溶于水,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四元轴烯t,苯乙烯b及立方烷c的结构简式如下,下列说法正确的是
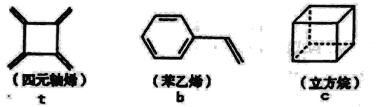
A.b的同分异构体只有t和c两种B.t和b能使酸性KMnO4溶液褪色而c不能
C.t、b、c的二氯代物均只有三种D.b中所有原子-定不在同-个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述一定正确的是( )


A. 图1表示合成氨(放热反应),温度T1和T2对应的平衡常数为K1、K2,则T1<T2,K1>K2
B. 图2所示,反应:X(g)+2Y(g)![]() 3Z(g),b的温度比a高
3Z(g),b的温度比a高
C. 图3表明,该温度下,加入FeCl3不可能引起由b向a的变化
D. 图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.0500 mol·L-1H2C2O4溶液滴定 25.00 mL0.l000mol·L-1NaOH溶液所得滴定曲线如图。下列说法正确的是()
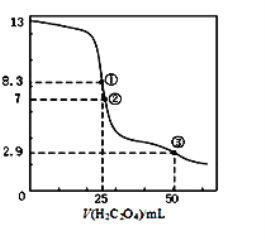
A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
B.点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C.点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D.滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MaO。某学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。

已知:溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨其饱和溶液中c(OH-)约为1×10-3mol·L-1。
(1)写出A与氢氧化钠溶液反应的离子方程式:______________________________。
(2)上述流程中两次使用试剂①,推测试剂①应该是____________(填字母)
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)H中溶质是______________。(填化学式)
(4)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是______________ 。
(4)计算溶液F中c(Mg2+)=______________ (25℃时,氢氧化镁的Ksp=5.6×10-12)
II.某化学兴趣小组用下图所示装置进行电化学原理的实验探究。
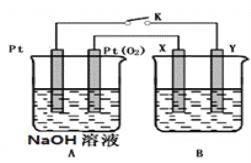
(1)A装置为乙醇燃料电池,若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为________________________。
(2)若B电池的电解质溶液为500mL1.0mol/L的NaCl溶液,X、Y皆为惰性电极,当电池工作一段时间断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变)此时B电池溶液的pH=____________,要是该溶液恢复到原来的状态,需加入____________(填物质并注明物质的量)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.56gN2与CO的混合物中原子总数是4NA
B.0.1mol/L的硫酸溶液中含H+的数目为0.2 NA
C.3mol单质Fe完全燃烧转变为Fe3O4,Fe得到8NA个电子
D.标准状况下,22.4LH2O所含的氧原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用如下图所示的装置制取氯化铜(部分仪器和夹持装置已略去)。
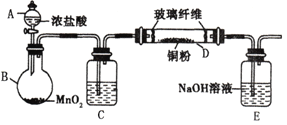
(1)C中试剂是____________。
(2)下列说法不正确的是______________。
A.玻璃纤维的作用是防止E中液体倒吸入D中
B.E中液体用于吸收多余的氯气和氯化氢
C.要使B中产生氯气,应先加热圆底烧瓶,再滴加浓盐酸
D.实验中加热的先后顺序为:先加热圆底烧瓶B,再加热硬质玻璃管D
(3)写出B 中反应的离子方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com