
【题目】向2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)![]() D(g)+E(g)△H=QkJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g)△H=QkJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的物质的量如表:
物质的量(mol) 时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T℃时,该反应的平衡常数K=___________。
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是______(填字母编号)。
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2mol B、0.1molD、0.1mol E
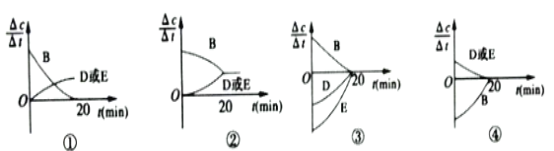
(3)对于该反应,用各物质的反应速率与时间的关系曲线表示如下,示意图中的___________(填序号)正确。
(4)容器的体积和温度T1℃不变,向该容器中加入1.60molB、0.20molD、0.20molE和0.4molA,达到平衡后,与表格中20分钟时各物质的浓度完全相同,投入固体A的物质的量n的取值范围是___________。
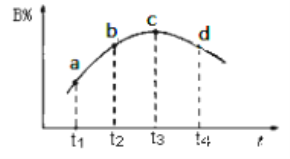
(5)若该密闭容器绝热,实验测得B的转化率随温度变化如图所示。由图可知,Q_________0(填“大于”或“小于),c点v正__________v逆(填“大于”、“小于”或“等于”)。
【答案】0.25 ae ④ n>0.3 小于 等于
【解析】
(1)根据表格中的数据,在20min反应达到平衡,A(s)+2B(g)![]() D(g)+E(g)
D(g)+E(g)
起始(mol) 2.00 0 0
变化(mol) 1.00 0.50 0.50
平衡(mol) 1.00 0.50 0.50
根据平衡常数的定义,K=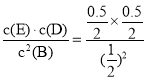 =0.25;
=0.25;
(2)a、通入一定量的B,平衡向正反应方向进行,BDE都增大,故a符合题意;
b、A为固体,浓度视为常数,增加固体A,平衡不移动,故b不符合题意;
c、反应前后气体系数之和相等,缩小容器的体积,气体压强增大,平衡不移动,故c不符合题意;
d、改变温度,平衡发生移动,BDE不会都增大,故d不符合题意;
e、同时加入0.2molB、0.1molD、0.1molE,相当于在原来的基础增大压强,平衡不移动,物质的量都增大,故e符合题意;
答案选ae;
(3)①化学平衡为动态平衡,即B的反应速率不能为0,故①不符合题意;
②B的系数与D和E系数不相等,即达到平衡时B的速率与D、E的反应速率不能相等,故②不符合题意;
③D和E变化速率相同,故③不符合题意;
④DE速率相同,图像表示逆向进行,B的反应速率增大,DE反应速率减小,故④符合题意;
答案选④;
(4)由提供的数据可知,与表格中20min时各物质的浓度完全相同时,生成D、E的量为(0.5-0.2)mol=0.3mol,A的量要够转化,A的量不小于0.3mol,即n>0.3mol;
(5)根据图像,c点达到平衡,随着温度的升高,B的转化率减小,根据勒夏特列原理,正反应方向为放热反应,即Q<0,c点为平衡,即正反应速率等于逆反应速率。


科目:高中化学 来源: 题型:
【题目】C1O2是常用的自来水消毒剂。
I.已知实验室可用亚氯酸钠固体与氯气反应制备ClO2:2NaClO2+C12 =2C1O2+2NaCl,装置如下图所示:

(1)圆底烧瓶内发生反应的化学方程式是:__________。
(2)已知常温常压下,ClO2和Cl2是气体,在下列溶剂中溶解性如下表所示:
ClO2 | Cl2 | |
水 | 极易溶于水 | 溶 |
CCl4 | 难溶 | 溶 |
B、C、E装置中的试剂依次是_________(填序号)。
a.NaOH溶液 b.浓硫酸 c.饱和食盐水 d.CCl4 e.饱和石灰水
II.使用C1O2在给自来水消毒的过程中会产生有害的副产物亚氯酸根(ClO2-),可用Fe2+将其去除。已知ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,而ClO2-则被还原成Cl-。
(3)Fe2+消除ClO2-的离子方程式为_______。
(4)实际向自来水中加入Fe2+的量要高于理论值,原因是(结合离子方程式解释)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四元轴烯t,苯乙烯b及立方烷c的结构简式如下,下列说法正确的是
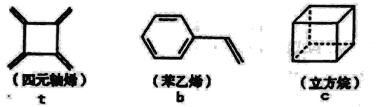
A.b的同分异构体只有t和c两种B.t和b能使酸性KMnO4溶液褪色而c不能
C.t、b、c的二氯代物均只有三种D.b中所有原子-定不在同-个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.0500 mol·L-1H2C2O4溶液滴定 25.00 mL0.l000mol·L-1NaOH溶液所得滴定曲线如图。下列说法正确的是()
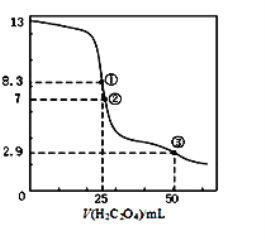
A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
B.点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C.点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D.滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MaO。某学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。

已知:溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨其饱和溶液中c(OH-)约为1×10-3mol·L-1。
(1)写出A与氢氧化钠溶液反应的离子方程式:______________________________。
(2)上述流程中两次使用试剂①,推测试剂①应该是____________(填字母)
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)H中溶质是______________。(填化学式)
(4)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是______________ 。
(4)计算溶液F中c(Mg2+)=______________ (25℃时,氢氧化镁的Ksp=5.6×10-12)
II.某化学兴趣小组用下图所示装置进行电化学原理的实验探究。
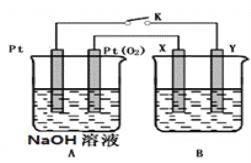
(1)A装置为乙醇燃料电池,若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为________________________。
(2)若B电池的电解质溶液为500mL1.0mol/L的NaCl溶液,X、Y皆为惰性电极,当电池工作一段时间断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变)此时B电池溶液的pH=____________,要是该溶液恢复到原来的状态,需加入____________(填物质并注明物质的量)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)由N2、NO、CO2组成的混合气体中,三种成分的体积分数之比为1:2:1,则三种成分的质量比为________。
(2)等质量的钠和镁分别与足量的稀硫酸反应,放出气体的体积(同温同压)之比为________。
(3)同温同压下,某容器充满CO2重122 g,充满NO气体重115 g,现充满某气体B重123 g,则该气体的相对分子质量为_____。
(4)有15 g A物质和10.5 g B物质恰好完全反应生成7.2 g C物质、1.8 g D物质和0.3 mol E物质,则E物质的摩尔质量是_____g·mol-1。
(5)标准状况下,10 mL N2气体恰好与30 mL H2完全反应生成20 mL气体A,则A的分子式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.56gN2与CO的混合物中原子总数是4NA
B.0.1mol/L的硫酸溶液中含H+的数目为0.2 NA
C.3mol单质Fe完全燃烧转变为Fe3O4,Fe得到8NA个电子
D.标准状况下,22.4LH2O所含的氧原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇一空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图甲所示,该电池中正极的电极反应式为_____。
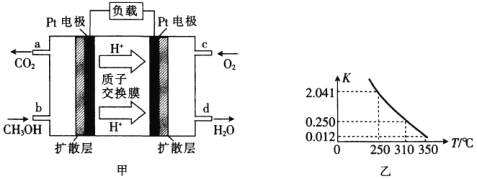
(2)工业上合成甲醇一般采用下列反应:![]() ,
,![]() ,图乙是该反应在不同温度下的化学平衡常数(K):
,图乙是该反应在不同温度下的化学平衡常数(K):
①由图中数据判断a_______0(填“>”“=”或“<”)。
②某温度下,将2molCO和6molH2充入2L的恒容密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol·L-1,则此时的温度为________℃。
(3)T℃时,在恒容密闭容器中发生反应:![]() ,各物质的浓度变化如图丙所示:
,各物质的浓度变化如图丙所示:
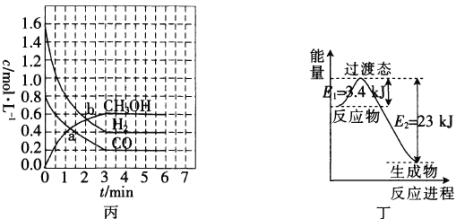
①反应从0min到3min之间,CH3OH的反应速率为________________。
②CO在0~1min和1~3min时平均反应速率[平均反应速率分别以v(0~1),v(1~3)表示]的大小为_____________________________。
(4)目前工业上有一种方法是用CO2和H2在230℃、催化剂条件下转化生成甲醇蒸气和水蒸气。图丁表示恒压容器中0.5molCO2和1.5molH2反应时转化率达80%的能量变化示意图。写出该反应的热化学方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中钌(Ru)与铁相邻位于铁的下一周期,某钌光敏太阳能电池的工作原理如下图所示,图中RuII*表示激发态。下列说法正确的是

A. 电池工作时,直接将太阳能转化为电能
B. 理论上,n(被还原的I3-):n(被氧化的Ru II*)=1:2
C. 在周期表中,钌位于第五周期第ⅧB族
D. 电池工作时,正极的电极反应式为Ru3++e-=Ru2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com