
【题目】2019年是元素周期表诞生150周年,目前周期表七个周期均已排满,共118种元素。短周期元素W、X、Y、Z在周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。
下列说法不正确的是
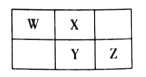
A. 最高价氧化物对应水化物的酸性:Z>Y
B. W的氢化物与Z的氢化物反应,产物的水溶液呈碱性
C. 在元素周期表中,117号元素与Z元素位于同一主族
D. 工业上常用YX2漂白纸浆、毛、丝等
【答案】B
【解析】
设X的最外层电子数为x,则由相对位置可知,W、Y、Z的最外层电子数依次为x-1、x、x+1,根据W、X、Y、Z的原子最外层电子数之和为24,有:x-1+x+x+x+1=24,解得x=6,由此可确定W、X、Y、Z分别为N、O、S、Cl,据此解答。
综合以上分析,W、X、Y、Z分别为N、O、S、Cl,
A. 元素的非金属性Cl>S,所以最高价氧化物对应水化物的酸性:HClO4>H2SO4,故A正确;
B. W的氢化物为NH3,Z的氢化物为HCl,NH3和HCl反应生成NH4Cl,NH4Cl为强酸弱碱盐水解,溶液呈酸性,故B错误;
C. 在元素周期表中,117号元素与0族元素的118号元素相邻,则位于第七周期第VIIA族,与Cl元素位于同一主族,故C正确;
D. 二氧化硫具有漂白性,工业上常用SO2漂白纸浆、毛、丝等,故D正确。
故答案选B。


科目:高中化学 来源: 题型:
【题目】把200mL含有BaCl2和KCl的混合溶液分成2等份,一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( )
A.0.1(b-2a)B.10(2a-b)C.10(b-a)D.10(b-2a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 mL H2SO4和CuSO4的混合液中,用石墨作电极进行电解,两极上均收集到2.24 L气体(标准状况下),则原混合液中Cu2+的物质的量浓度为( )
A. 1 mol·L-1 B. 2 mol·L-1 C. 3 mol·L-1 D. 4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C1O2是常用的自来水消毒剂。
I.已知实验室可用亚氯酸钠固体与氯气反应制备ClO2:2NaClO2+C12 =2C1O2+2NaCl,装置如下图所示:

(1)圆底烧瓶内发生反应的化学方程式是:__________。
(2)已知常温常压下,ClO2和Cl2是气体,在下列溶剂中溶解性如下表所示:
ClO2 | Cl2 | |
水 | 极易溶于水 | 溶 |
CCl4 | 难溶 | 溶 |
B、C、E装置中的试剂依次是_________(填序号)。
a.NaOH溶液 b.浓硫酸 c.饱和食盐水 d.CCl4 e.饱和石灰水
II.使用C1O2在给自来水消毒的过程中会产生有害的副产物亚氯酸根(ClO2-),可用Fe2+将其去除。已知ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,而ClO2-则被还原成Cl-。
(3)Fe2+消除ClO2-的离子方程式为_______。
(4)实际向自来水中加入Fe2+的量要高于理论值,原因是(结合离子方程式解释)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0mol/LKNO3溶液:H+、Fe2+、SCN-、SO42-
B. pH =0的溶液:Al3+、CO32-、Cl-、SO42-
C.![]() 的溶液:K+、Ba2+、NO3-、Cl-
的溶液:K+、Ba2+、NO3-、Cl-
D.无色溶液:Na+、SO32-、Cu2+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭的燃料之一是铝粉与高氯酸铵(NH4ClO4)的固体混合物,点燃时,铝粉被氧化。放热引发高氯酸铵反应:2NH4ClO4═N2↑+4H2O+Cl2↑+2O2↑,反应放出大量热。
(1)该反应中被氧化的元素是___和___;
(2)氧化产物与还原产物的质量之比为___;
(3)该反应中若生成标况下2.24LCl2时,电子转移数为___;
(4)若生成的水在高温下也为气态,则混合气体的平均摩尔质量为__g/mol(小数点后保留一位)。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,易溶于水,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四元轴烯t,苯乙烯b及立方烷c的结构简式如下,下列说法正确的是
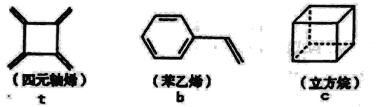
A.b的同分异构体只有t和c两种B.t和b能使酸性KMnO4溶液褪色而c不能
C.t、b、c的二氯代物均只有三种D.b中所有原子-定不在同-个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.56gN2与CO的混合物中原子总数是4NA
B.0.1mol/L的硫酸溶液中含H+的数目为0.2 NA
C.3mol单质Fe完全燃烧转变为Fe3O4,Fe得到8NA个电子
D.标准状况下,22.4LH2O所含的氧原子数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com