
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
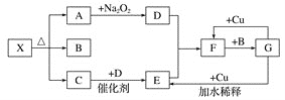
(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
【答案】NH4HCO3(或(NH4)2CO3) 2Na2O2+2CO2=2Na2CO3+O2 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 3NO2+H2O=2HNO3+NO 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
【解析】
和过氧化钠反应的气体是二氧化碳气体,生成氧气,氧气与C在催化剂作用下反应,说明C为氨气,E为一氧化氮,F为二氧化氮,G为硝酸,B为水蒸气。
⑴根据X分解得到水、二氧化碳、氨气得出X可能为NH4HCO3(或(NH4)2CO3),故答案为NH4HCO3(或(NH4)2CO3)。
⑵①A→D是过氧化钠和水的反应,其方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2。
②G→E是铜和硝酸的反应,其方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,故答案为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
③F→G是二氧化氮和水的反应,其方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO。
⑶实验室里常用加热氯化铵和氢氧化钙固体混合物的方法制取气体C,其化学方程式:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。


科目:高中化学 来源: 题型:
【题目】环己烯是重要的有机合成原料,常用作高辛烷值汽油稳定剂。其实验室制备流程如下:
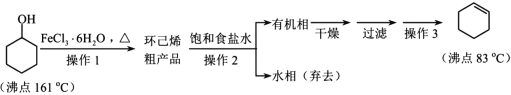
请回答下列问题:
(1)实验室用FeCl3 溶液制备 FeCl3·6H2O 的方法是__________。
(2)操作 1 的装置如图所示(加热和夹持装置已略去)。
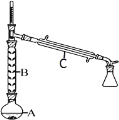
①仪器B的作用为_________。
②烧瓶A中进行的可逆反应化学方程式为_______
(3)浓硫酸也可作该反应的催化剂,选择 FeCl3·6H2O 而不用浓硫酸的原因为________(填选项)。
A.浓硫酸易使原料碳化并产生 SO2
B.FeCl3·6H2O 污染小、可循环使用,符合绿色化学理念
C.同等条件下,用 FeCl3·6H2O 比浓硫酸的平衡转化率高
(4)操作2用到的玻璃仪器是____________。
(5)环己烯含量的测定:在一定条件下,向 a g 环己烯样品中加入定量制得的b mol Br2, 与环己烯充分反应后,剩余的 Br2 与 足 量 KI 作用生成 I2 ,用 c molL-1 的 Na2S2O3标准溶液滴定,终点时消耗 Na2S2O3 标准溶液 v ml(以上数据均已扣除干扰因素)。测定过程中,发生的反应如下:
①![]() +Br2→
+Br2→![]()
② Br2+ KI=I2 + 2KBr
③ I2 + 2Na2S2O3=2 NaI+ Na2S4O6
滴定所用指示剂为_____________________ ;样品中环己烯的质量分数为_________________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】农业上有一句俗语“雷雨发庄稼”,该过程中不会涉及到的化学反应是
A.N2+O2 ![]() 2NOB.2NO+O2 → 2NO2
2NOB.2NO+O2 → 2NO2
C.4NH3+5O2![]() 4NO + 6H2OD.3NO2+H2O → 2HNO3+NO
4NO + 6H2OD.3NO2+H2O → 2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如下图所示,试回答:
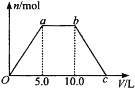
(1)a点之前的反应的离子方程式为________________。
(2)a点到b点之间的反应的离子方程式是________________、________________。
(3)c点二氧化碳体积是________L。
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分:Al2O3、SiO2、少量Fe2O3)为原料,制取Al2O3的部分工艺流程如下:

完成下列填空:
(1)铝原子核外有_____种不同能量的电子,最外层电子的轨道式是_____________,上述流程涉及第二周期元素的原子半径由小到大的顺序是______________________________。
(2) “除铁”是将Fe3+转化为Fe(OH)3沉淀,反应的离子方程式为______________________,检验溶液中Fe3+是否除尽的方法是____________________________________________。
(3)解释“结晶”过程中向AlCl3浓溶液中通入HCl气体的原因。______________________
(4)上述流程可循环的物质是_______________。
(5)工业上将Al2O3溶解在熔化的冰晶石中电解获得铝,该反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每年10月23日上午6:02到晚上6:02倍誉为“摩尔日”(Mole Day),这个时间的美式写法为6:02 10/23,外观与阿伏伽德罗常数6.02×1023相似。设NA为阿伏伽德罗常数的值,下列说法正确的是
A.7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为0.1NA
B.1L0.1mol·L-1碳酸钠溶液中含有的氧原子数为0.3NA
C.将100mL 0.1mol·L-1FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数为0.01NA
D.将CO2通过0.1mol Na2O2时,反应共转电子数为移0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g),如图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
2SO3(g),如图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
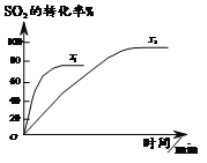
完成下列填空:
(1)T1__________(选填“>”“<”或“=”)T2,判断依据是_______________;该反应为___________(选填“放”或“吸”)热反应,判断依据是__________。
(2)下表为一定温度和压强下,4种投料比[n(SO2):n(O2)]分别为2:18、4:15、7:11和8:10时SO2的平衡转化率。
投料比 | ① | ② | ③ | ④ |
SO2平衡转化率/% | 97.1 | 96.8 | 95.8 | 90.0 |
②对应的投料比为_____。投料比为8:10时,平衡混合气体中SO3体积分数为______。
(3)在相同温度下:2NO(g)+O2(g)![]() 2NO2(g) K1=a;NO2(g)+SO2(g)
2NO2(g) K1=a;NO2(g)+SO2(g)![]() SO3(g)+NO(g) K2=b;则2SO2(g)+O2(g)
SO3(g)+NO(g) K2=b;则2SO2(g)+O2(g)![]() 2SO3(g) 的平衡常数K=__________(用a、b表示)。
2SO3(g) 的平衡常数K=__________(用a、b表示)。
(4)钠碱循环法吸收硫酸厂尾气中的SO2并将其转化为硫酸的工艺如下:

吸收池中发生反应的离子方程式是________;NaHSO3溶液呈弱酸性,NaHSO3溶液中离子浓度由大到小排序为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A.7.8g Na2O2中含有的离子总数为 0.4NA
B.标准状况下,22.4L 乙醇所含的分子数为0.1NA
C.常温常压下,0.18g H2O所含的电子数为0.1NA
D.常温常压下,3.2g O2所含的氧原子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某含有SO![]() 、SiO
、SiO![]() 、CO
、CO![]() 、Br-、Na+的溶液中缓慢通入Cl2直至过量,下列对该反应过程的判断不正确的是( )
、Br-、Na+的溶液中缓慢通入Cl2直至过量,下列对该反应过程的判断不正确的是( )
A. 整个过程共发生2个氧化还原反应
B. 所有阴离子的浓度都发生了变化
C. 溶液的颜色发生了变化
D. 反应过程中既有气体产生,也有沉淀产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com