
【题目】在研究合成氨方法的历史上,不同的研究者曾3次获诺贝尔化学奖。合成氨大大提高了农作物的产量,同时也是制取硝酸、炸药等的原料。下列说法中正确的是
A. N2和H2在点燃或光照条件下可合成NH3
B. NH3和HNO3溶于水后都能导电,故二者都是电解质
C. NH3遇到浓硝酸会发生反应产生大量白烟
D. 由NH3制HNO3的过程中,氮元素被还原
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+而可能含Fe2+ , 进行如下实验操作时的合理顺序是 ( ) ①加足量氯水 ②加足量酸性高锰酸钾溶液 ③加足量硫氰化钾溶液
A.①③
B.②③
C.③①
D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO,3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( ) 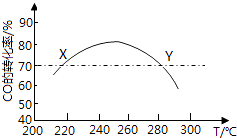
A.X,Y两点对应的CO正反应速率相等
B.合成二甲醚的正反应△H<0
C.反应温度应控制在260℃~280℃之间
D.选择合适催化剂,可以提高CO转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某兴趣小组根据课本实验设计的个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察下图的实验装置、分析实验原理,下列说法错误的是
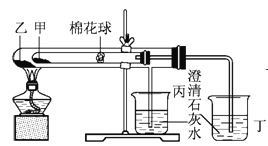
A. 甲为小苏打,乙为纯碱
B. 要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C. 整个实验过程中可以看到丙烧杯的澄清石灰水没变浑浊
D. 同质量的甲乙完全反应消耗的同浓度的盐酸体积:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示: 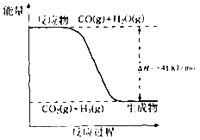
①反应的热化学方程式为 .
②已知:C(s)+H2O (g)═CO(g)+H2(g)△H=+131kJmoL﹣1
则C(s)+CO2(g)═2CO(g)△H= .
(2)化学反应可视为旧键断裂和新键形成的过程.:已知N≡N键的键能是948.9kJmol﹣1 , H﹣H键的键能是436.0kJmol﹣1;N﹣H键的键能是391.55kJ/mol..则 ![]() N2(g)+
N2(g)+ ![]() H2(g)═NH3(g)△H= .
H2(g)═NH3(g)△H= .
(3)在25℃、101Pa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. Cl2通入水中:Cl+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑
C. NaHCO3溶液跟足量的Ca(OH)2反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
D. H2SO4溶液中加入足量的Ba(OH)2溶液:SO42-+H++Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
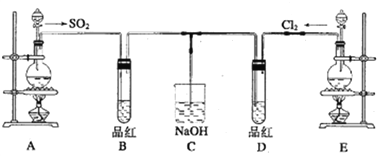
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,该同学怎样操作可以使分液漏斗液体顺利滴下___________________________;
(2)实验室用装置E制备Cl2,其反应的化学方程式为____________________,若实验室用酸性KMnO4和浓盐酸反应制Cl2,反应的离子方程式为________________________。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:_______________________,D:_________________________。
(4)若将B中品红换成Na2S溶液,通SO2一段时间后B中现象为_____________________。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素有三种核素16O、17O、18O,它们在自然界中所占的原子个数百分比分别为a%、b%、c%,则下列说法正确的是( )
A.一个16O原子的质量为16g
B.17O的相对原子质量约为17
C.氧元素的相对原子质量为 ![]()
D.氧元素的相对原子质量为(16a%+17b%+18c%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.Ⅰ.查阅材料
①连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
②2Na2S2O4+4HCl═4NaCl+S↓+3SO2↑+2H2O
Na2S2O3+2HCl═2NaCl+S↓+SO2↑+H2O
(1)制备方法75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:
HCOONa+Na2CO3+=Na2S2O4+CO2+
冷却至40℃~45℃,过滤,用洗涤,干燥制得Na2S2O4 .
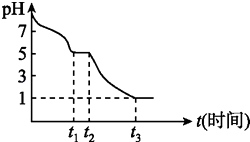
(2)Na2S2O4的性质①Na2S2O4 溶液在空气中易被氧化,课题小组测定0.050 molL﹣1 Na2S2O4 溶液在空气中pH变化如图:0~t1 段主要生成HSO3﹣ , 根据pH变化图,HSO3﹣的电离平衡水解平衡(填“<”或“>”),课题小组推测Na2S2O4 溶液在空气中易被氧化,0~t1 发生离子反应方程式为 . t3 时溶液中主要阴离子符号是 .
②隔绝空气加热Na2S2O4 固体完全分解得到固体产物Na2SO3、Na2S2O3 和气体为(填化学式).请你设计实验验证产物有Na2S2O3 存在,完成下表中内容.(供选择的试剂:稀盐酸、稀硝酸、BaCl2 溶液、KMnO4 溶液)
实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com