
����Ŀ����ҵ�ϣ�����CO��H2�ϳɶ����ѣ�3CO��g��+3H2��g��CH3OCH3��g��+CO2��g���ں��ʵ��¶��£��о��߽����˶��ʵ�飬ÿ��ʵ�鱣��ԭ������ɣ�3molCO��3molH2���������10L������Ӧʱ������ز��䣬ʵ������ͼ��ʾ������˵����ȷ���ǣ� �� 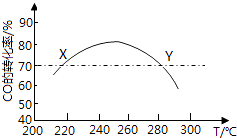
A.X��Y�����Ӧ��CO����Ӧ�������
B.�ϳɶ����ѵ�����Ӧ��H��0
C.��Ӧ�¶�Ӧ������260�桫280��֮��
D.ѡ����ʴ������������COת����
���𰸡�B
���������⣺A��X��Y�����Ӧ���¶Ȳ�ͬ����Ӧ���ʲ�ͬ����A����B��ת���ʴﵽ��ߵ�֮�������¶�ת���ʽ��ͣ�˵�������¶�ƽ�������ƶ�����˵����ӦΪ���ȷ�Ӧ����B��ȷ��
C.240�桫260��֮��ת������ߣ�Ӧ�����ڴ��¶����䷶Χ����C����
D��������Ӱ��ƽ���ƶ���ת���ʲ��䣬��D����
��ѡB��
�����㾫�������û�ѧƽ��״̬���ʼ���������Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����


 ������ʱͬ����ϰ��ϵ�д�
������ʱͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ũ����ʹ�������ܷ������·�Ӧ��Ca(ClO)2��4HCl(Ũ)===CaCl2��2Cl2����2H2O��������ܾõ�Ư�ۺ�Ũ���ᷴӦ�Ƶõ������У����ܺ��е���������Ϊ��CO2 �� ��HCl����H2O����O2�е� (����)
A.�٢ڢ�
B.�ڢۢ�
C.�٢ڢۢ�
D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��A��B��ԭ��������С��18����֪AԪ��ԭ������������Ϊa������������Ϊb��BԪ��ԭ�ӵ�M���������a-b��L���������a+b����A��B��Ԫ�����γɵĻ�����ľ�������Ϊ
A.���Ӿ���B.ԭ�Ӿ���C.���Ӿ���D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ����б�¶һ��ʱ�����������ƹ�����Ʒ����ˮ����ҺA����������Һ����εμ�ϡ���������������ɵĶ�����̼���(��״����)�����ϡ���������ϵ��ͼ��ʾ��
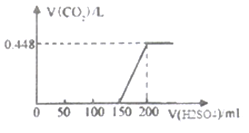
��1����ҺA�еμ�����������0-150mL����CO2�������ɵ�ԭ����(�û�ѧ����ʽ��ʾ)_________________________________________________________��
��2������μ���150mLʱ�ܲ���������Ҫ�ɷ�Ϊ(д��ѧʽ)_______________��
��3����ҺA��̼���Ƶ�����Ϊ____g��
��4����������ʵ���Ũ��Ϊ______mol/L��
��5������Ʒ��Na2CO3��NaOH���ʵ���֮��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ��Ӧ���ʵ���Ҫ������(����)
A.�μӷ�Ӧ�����ʱ���������
B.����
C.�¶ȡ�ѹǿ�Լ���Ӧ��ĽӴ���
D.��Ӧ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ���������������ȷ����( )
A. ���ǵؿ��к������Ľ���Ԫ��
B. ���DZȽϻ��õĽ������ڻ�ѧ��Ӧ������ʧȥ���ӣ����ֳ���ԭ��
C. �����ڿ������þƾ��Ƽ��ȿ����ۻ����ҷ�������ȼ��
D. �����ڿ������þƾ��Ƽ��ȿ��Թ۲쵽���ۻ��˵��������䡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶�ʱ��N2��H2��Ӧ�����������仯��������ͼ������������ȷ���ǣ� �� 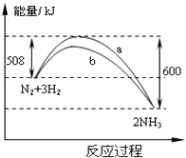
A.�÷�Ӧ���Ȼ�ѧ����ʽΪ��N2+3H22NH3��H=��92kJ/moL
B.b�����Ǽ������ʱ�������仯����
C.����������û�ѧ��Ӧ�ķ�������
D.�����������������Ӧ���ʣ������淴Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����о��ϳɰ���������ʷ�ϣ���ͬ���о�����3�λ�ŵ������ѧ�����ϳɰ���������ũ����IJ�����ͬʱҲ����ȡ���ᡢըҩ�ȵ�ԭ�ϡ�����˵������ȷ����
A. N2��H2�ڵ�ȼ����������¿ɺϳ�NH3
B. NH3��HNO3����ˮ���ܵ��磬�ʶ��߶��ǵ����
C. NH3����Ũ����ᷢ����Ӧ������������
D. ��NH3��HNO3�Ĺ����У���Ԫ�ر���ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����500mL 2.0mol/L NaOH��Һ����0.8mol SO2��SO32- ��HSO3- �����ʵ���Ũ��֮���ǣ� ��
A. 1 : 3 B. 3��1 C. 5��4 D. 4: 5
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com