
【题目】决定化学反应速率的主要因素是( )
A.参加反应的物质本身的性质
B.催化剂
C.温度、压强以及反应物的接触面
D.反应物的浓度
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列物质的分离或提纯,不可能选用蒸馏、过滤、萃取分液的是( )
A. 除去粗盐溶液中混有的泥沙B. 从碘水中提取碘
C. 从氯化钠溶液中获取氯化钠D. 分离酒精和水的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).
阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
阴离子 | OH﹣、Cl﹣、CO |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: .
(2)写出E溶液与过量的B溶液反应的离子方程式 .
(3)已知:NaOH(aq)+HNO3(aq)═NaNO3(aq)+H2O(l);△H=﹣akJmol﹣1 . 请写出B与C的稀溶液反应的热化学方程式 .
(4)在100mL 0.1 molL﹣1E溶液中,逐滴加入35 mL 2 molL﹣1NaOH溶液,最终得到沉淀的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的浓度变 化如图(Ⅰ)所示.保持其他条件不变,在T1、T2两种温度下,Y的体积分数变化如图(Ⅱ)所示.下列结论正确的是( ) 
A.t2时,保持其它条件和物质状态不变,增加压强,化学平衡向逆反应方向移动
B.T℃时,若密闭容器中各物质起始浓度为:0.4 mol/L X、0.4 mol/L Y、0.2 mol/L Z.保持其他条件不变,达到平衡时z的浓度为0.4 mol/L
C.图(Ⅱ)中T1>T2 , 则正反应是吸热反应
D.其他条件不变,升高温度,正、逆反应速率均增大,且X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO,3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( ) 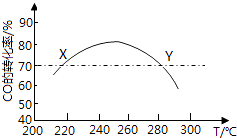
A.X,Y两点对应的CO正反应速率相等
B.合成二甲醚的正反应△H<0
C.反应温度应控制在260℃~280℃之间
D.选择合适催化剂,可以提高CO转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答. 
①a、b、c三点的氢离子浓度由小到大的顺序为 .
②a、b、c三点中,醋酸的电离程度最大的一点是 .
③测得某醋酸溶液中氢离子浓度为0.004molL﹣1 , 则醋酸的电离度为 , 该温度下醋酸的电离平衡常数K=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示: 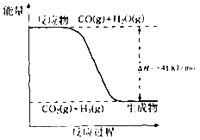
①反应的热化学方程式为 .
②已知:C(s)+H2O (g)═CO(g)+H2(g)△H=+131kJmoL﹣1
则C(s)+CO2(g)═2CO(g)△H= .
(2)化学反应可视为旧键断裂和新键形成的过程.:已知N≡N键的键能是948.9kJmol﹣1 , H﹣H键的键能是436.0kJmol﹣1;N﹣H键的键能是391.55kJ/mol..则 ![]() N2(g)+
N2(g)+ ![]() H2(g)═NH3(g)△H= .
H2(g)═NH3(g)△H= .
(3)在25℃、101Pa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
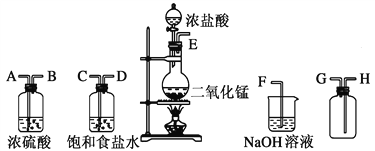
(1)连接上述仪器的正确顺序(填各接口处的字母)____________________。
(2)装置中,饱和食盐水的作用是_____________________;NaOH溶液的作用是____________。
(3)化学实验中常用湿润的淀粉-KI试纸检验是否有Cl2产生。如果有Cl2产生,可观察到________________________,反应离子方程式为:__________________。
(4)写出下列化学反应的方程式:
①气体发生装置进行的反应:_________________②NaOH溶液中发生的反应:____________
(5)若将生成的Cl2通入到分别置有干燥有色布条和湿润有色布条的两个集气瓶中,会看到什么现象: _____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com