
【题目】如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )

A.该实验说明氨气是一种极易溶于水的气体
B.进入烧瓶中的液体颜色由无色变为红色,说明氨水有碱性
C.氨水很稳定,将烧瓶中的红色溶液加热,颜色不会发生变化
D.形成“喷泉”的主要原因是氨气溶于水后,烧瓶内的气压小于大气压
科目:高中化学 来源: 题型:
【题目】标准状况下的甲烷和一氧化碳的混合气体8.96L,其质量为7.6g,则:
(1)混合气体平均相对分子量为____;一氧化碳的质量为_____。
(2)将上述混合气体与标准状况下16.8L的氧所混合点燃,完全反应后,冷却至标准状况,反应后混合气体的平均相对分子质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:—CHO+ +H2O,由于醚键比较稳定故利用此反应可保护醛基,也可以合成缩醛类有机物,下列说法中不正确的是( )
+H2O,由于醚键比较稳定故利用此反应可保护醛基,也可以合成缩醛类有机物,下列说法中不正确的是( )
A.保护1mol醛基时也可用![]()
B.合成1mol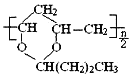 需要1mol
需要1mol![]() 和
和![]()
C.通过上述反应合成的![]() 其核磁共振氢谱中峰面积之比为1:1:1:1:1:2:2:3
其核磁共振氢谱中峰面积之比为1:1:1:1:1:2:2:3
D.![]() 可由
可由![]() 与
与![]() 通过上述反应得到
通过上述反应得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据所学知识回答下列问题:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1 ____ΔH2(填“>”、“<”或“=”,下同)。
(2)相同条件下,1 mol氮气和氢气反应断键吸收能量____形成2 mol氨气成键所放出的能量。
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1___ΔH2。①P4(白磷,s)+5O2(g)= 2P2O5(s) ΔH1, ②4P(红磷,s)+5O2(g)= 2P2O5(s) ΔH2。
(4)25℃ 1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36 kJ热量,该反应的热化学方程式是_______。
(5)已知:0.5 mol CH4(g)与0.5 mol水蒸气在t℃、p kPa时,完全反应生成CO和H2的混合气体,吸收了a kJ热量,该反应的热化学方程式是_______。
(6)已知:C(s)+O2(g)=CO2(g) △H=-437.3kJmol﹣1,H2(g)+![]() O2(g)=H2O(g) △H=-285.8kJmol﹣1,CO(g)+
O2(g)=H2O(g) △H=-285.8kJmol﹣1,CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJmol﹣1,煤的气化主要反应的热方程式C(s)+H2O(g)=CO(g)+H2(g) △H=__kJmol﹣1。
O2(g)=CO2(g) △H=-283.0kJmol﹣1,煤的气化主要反应的热方程式C(s)+H2O(g)=CO(g)+H2(g) △H=__kJmol﹣1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z均为短周期主族元素,Y的原子序数是W和Z的原子序数之和的一半,Y原子的最外层电子数与核外电子总数之比为2:7;W和Z形成的可溶性化合物WZ溶于水中不能促进水的电离;W、X、Z三种元素形成的某种化合物能消毒杀菌.下列说法正确的是
A.四种元素原子中,原子半径最大的是Z
B.X、Y形成的化合物能溶于盐酸
C.最高价氧化物对应水化物的酸性:Z强于Y
D.1molW单质与足量X单质反应,转移的电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生反应 mA(g)+nB(g)![]() pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/3,达到平衡时,C的浓度为原来的2.5倍,则下列说法正确的是
pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/3,达到平衡时,C的浓度为原来的2.5倍,则下列说法正确的是
A. C的体积分数增加 B. A的转化率降低
C. 平衡向正反应方向移动 D. m+n>p
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是

A. 放电时,a电极反应为
B. 放电时,溶液中离子的数目增大
C. 充电时,b电极每增重![]() ,溶液中有
,溶液中有![]() 被氧化
被氧化
D. 充电时,a电极接外电源负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F、G、H八种原子序数依次增大的元素(原子序数均小于30).A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,A、E同主族,F的基态原子s能级的电子总数与p能级的电子数相等,B、G同族,H的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:
(1)H元素在周期表中属于 ______ 区.G的基态原子电子排布式为 ______ CD2+中C的杂化类型是 ______
(2)下列说法不正确的是 ______ .
a.B2A2分子中含有σ键和π键 b.B2A2分子的沸点明显低于A2D2分子
c.A2D2分子的空间构型为直线形 d.B、C、D的电负性由大到小的顺序为D>C>B
e.B、C、D的第一电离能由大到小的顺序为D>C>B
f.H2+能与BD分子形成[H(BD)]2+,其原因是BD分子中含有空轨道
g.B和G的单质能形成相同类型的晶体,其熔点B>G
(3)由B、F、H三种元素形成的一种具有超导性的晶体,B位于F和H原子紧密堆积所形成的空隙当中.晶胞如图1所示,该晶体的化学式为 ______
(4)CD2、D2和熔融ECD3可制作燃料电池,其原理如图2所示.该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,石墨Ⅰ电极反应式为 ______
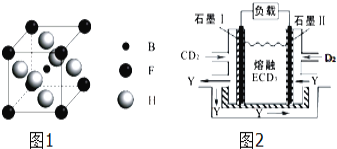
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示的是纯净物、单质、化合物、含氧化合物、氧化物、碱之间的包含、不包含关系,若整个大圆圈代表纯净物,则下列选项中,能正确指出①、②、③、④、⑤所属物质类别的是( )
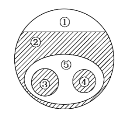
A. ①单质、③化合物
B. ②碱、⑤氧化物
C. ④碱、⑤含氧化合物
D. ④含氧化合物、③氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com