
【题目】标准状况下的甲烷和一氧化碳的混合气体8.96L,其质量为7.6g,则:
(1)混合气体平均相对分子量为____;一氧化碳的质量为_____。
(2)将上述混合气体与标准状况下16.8L的氧所混合点燃,完全反应后,冷却至标准状况,反应后混合气体的平均相对分子质量为_____。
【答案】19 2.8g 41.6
【解析】
(1)设出甲烷和一氧化碳的物质的量,根据n=![]() =
=![]() 列式计算;
列式计算;
(2)判断氧气与混合气体的反应程度,进而确定冷却后气体的组成及所得气体的相对分子质量。
(1)标况下8.96L气体的物质的量为:![]() =0.4mol,混合气体平均摩尔质量为:
=0.4mol,混合气体平均摩尔质量为:![]() =19g/mol,则混合气体平均相对分子量为19;
=19g/mol,则混合气体平均相对分子量为19;
设混合气体中甲烷、CO的物质的量分别为x、y,则:x+y=0.4mol、16x+28y=7.6g,解得:x=0.3mol、y=0.1mol;一氧化碳的质量为:28g/mol×0.1mol=2.8g;
(2)将上述混合气体与标准状况下16.8L的氧气混合点燃,氧气的物质的量为:![]() =0.75mol,发生反应为CH4+2O2=CO2+2H2O消耗氧气0.6mol、2CO+O2=2CO2消耗氧气0.05mol,则混合气体完全反应消耗氧气的物质的量为:0.6mol+0.05mol=0.65mol<0.75mol,说明氧气过量,反应后混合气体中含有0.4molCO2、0.1molO2,则混合气体的平均摩尔质量为:
=0.75mol,发生反应为CH4+2O2=CO2+2H2O消耗氧气0.6mol、2CO+O2=2CO2消耗氧气0.05mol,则混合气体完全反应消耗氧气的物质的量为:0.6mol+0.05mol=0.65mol<0.75mol,说明氧气过量,反应后混合气体中含有0.4molCO2、0.1molO2,则混合气体的平均摩尔质量为:![]() =41.6g/mol,混合气体的平均相对分子质量为41.6。
=41.6g/mol,混合气体的平均相对分子质量为41.6。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】如图容器底部是培养基,其中含有植物生长所需的全部养分,如果有人在配制培养基的矿质元素中使用了NH4NO3、KNO3、CaCl2·2H2O、MgSO4·7H2O、螯合铁溶液、微量元素溶液,但缺少了一种必需元素,为补充这种元素,应添加的化合物是( )

A.Ca(NO3)2B.KClC.KH2PO4D.K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)青奥会将于2014年8月在南京举行。青奥会建筑设施使用了大量节能材料,体现了“绿色青奥”的理念。
①用于青奥村工程的隔热保温材料聚氨酯属于______(填字母)。
a.有机高分子材料 b.无机非金属材料 c.金属材料
②青奥中心外墙的复合保温材料采用铝合金锁边。有关铝合金的性质正确的是___(填字母)。
a.强度小 b.耐腐蚀 c.密度大
③青奥会议中心双塔采用了玻璃幕墙设计。制造玻璃的主要原料为纯碱、石灰石和___(填字母)。
a.金刚砂 b.石英 c.水玻璃
(2)如图为某品牌酱油标签的一部分。

①氨基酸态氮的含量是酱油质量的重要指标,这些氨基酸是由大豆中的主要营养物质_____水解而来的。
②配料清单中属于防腐剂的是______。
③小麦中的主要营养物质是_____,写出这种物质完全水解的化学方式:______。
(3)A、B、C三个城市全年雨水的月平均pH变化如图所示。
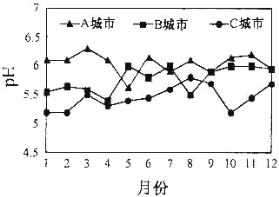
①受酸雨危害最严重的是____城市。
②导致硫酸型酸雨形成主要气体是___,减少燃煤过程产生该气体的措施有_________。
③汽车尾气中含有NO2、NO、CO等有害气体。写出由NO2形成硝酸型酸雨的化学方程式:______;汽车安装尾气净化装置可将NO、CO转化为无害气体,写出该反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛经催化加氢可制备1丁醇。为提纯含少量正丁醛杂质的1丁醇,现设计如下路线:
![]()
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1丁醇互溶;③1丁醇的沸点是118℃。
则操作1~4分别是______、_______、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的是
编号 | 实验内容 | 实验目的 |
A | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
C | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体,HX放出的氢气多且反应速率快 | 证明HX酸性比HY强 |
D | 向10mL 0.2mol/L NaOH溶液中滴2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下Ksp: Mg(OH)2>Fe(OH)3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在。现以Al—H2O2电池电解尿素CO(NH2)2的碱性溶液制备H2,下列说法不正确的是( )
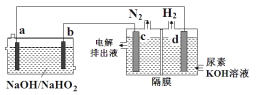
A.电解过程中,电子的流向由a→d→c→b
B.电池的正极反应为:HO2-+2e-+H2O=3OH-
C.电解时,消耗5.4gAl,则产生标况下2.24L N2
D.电极c是阳极,且反应后该电极区pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
(1)我国规定生活用水中镉排放的最大允许浓度为0.005 mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
①磷酸镉(Cd3(PO4)2)沉淀溶解平衡常数的表达式Ksp=_____________________。
②在某含镉废水中加人Na2S,当S2-浓度达到7.9 × 10-8mol/L时,水体中Cd2+浓度为_____mol/L(已知:Ksp(CdS)=7.9 × 10-27,Cd的相对原子质量:112);此时是否符合水源标准?______(填“是”或“否”)。
(2)炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
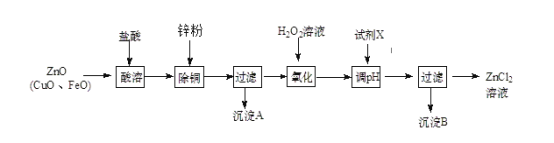
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 | Fe3+ | Zn2+ | Fe2+ |
开始沉淀的pH | 1. 1 | 5. 2 | 5. 8 |
沉淀完全的pH | 3. 2 | 6. 4 | 8. 8 |
①加入H2O2溶液的作用是________________。
②流程图中,调节pH时,加入的试剂X可以是________(填序号);
a、ZnO b、NaOH c、Zn2(OH)2CO3 d、ZnSO4
pH应调整到______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X____。
(2)上述实验流程中①②③步均要进行的实验操作是____(填操作名称)。
(3)上述实验流程中加入过量Na2CO3溶液的目的是____________。
(4)按此实验方案得到的溶液3中肯定含有杂质。为了解决这个问题,可以向溶液3中加入适量的________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )

A.该实验说明氨气是一种极易溶于水的气体
B.进入烧瓶中的液体颜色由无色变为红色,说明氨水有碱性
C.氨水很稳定,将烧瓶中的红色溶液加热,颜色不会发生变化
D.形成“喷泉”的主要原因是氨气溶于水后,烧瓶内的气压小于大气压
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com