
【题目】W、X、Y、Z均为短周期主族元素,Y的原子序数是W和Z的原子序数之和的一半,Y原子的最外层电子数与核外电子总数之比为2:7;W和Z形成的可溶性化合物WZ溶于水中不能促进水的电离;W、X、Z三种元素形成的某种化合物能消毒杀菌.下列说法正确的是
A.四种元素原子中,原子半径最大的是Z
B.X、Y形成的化合物能溶于盐酸
C.最高价氧化物对应水化物的酸性:Z强于Y
D.1molW单质与足量X单质反应,转移的电子数为![]()
【答案】C
【解析】
Y原子的最外层电子数与核外电子总数之比为2:7,则Y是Si元素;Y的原子序数是W和Z的原子序数之和的一半,W和Z的原子序数之和为28,WZ溶于水中不能促进水的电离,则W是Na元素、Z是Cl元素;W、X、Z三种元素形成的某种化合物能消毒杀菌,则X是O元素。
A. 电子层数越多半径越大,电子层数相同时,质子数越少,半径越大,四种元素原子中,原子半径最大的是Na,故A错误 ;
B. X、Y形成的化合物是SiO2,SiO2是酸性氧化物,不溶于盐酸,故B错误;
C. 非金属性越强,最高价氧化物对应水化物的酸性越强,酸性HClO4> H2SiO3,故C正确;
D. 1molNa与足量氧气反应,钠元素化合价由0升高为+1,所以转移的电子数为![]() ,故D错误;
,故D错误;
故答案选C。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的是
编号 | 实验内容 | 实验目的 |
A | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
C | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体,HX放出的氢气多且反应速率快 | 证明HX酸性比HY强 |
D | 向10mL 0.2mol/L NaOH溶液中滴2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下Ksp: Mg(OH)2>Fe(OH)3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡(SnCl4)常用于染色的媒染剂等,工业上常用氯气与金属锡反应制备四氯化锡,某研究性学习小组在实验室用以下装置模拟四氯化锡的制备(夹持装置略)。

已知:①金属锡熔点为231℃,化学活泼性与铁相似。
②SnCl4为无色液体,熔点-33℃,沸点114℃,极易水解生成SnO2·xH2O,在潮湿的空气中发烟。
③SnCl2中的Sn2+易被氧化为Sn4+。
请回答下列问题:
(1)仪器F的名称是_______________,装置B中的试剂是_____________(填名称)。
(2)实验前应先点燃_________(填“A”或“E”)处的酒精灯,待__________(填实验现象)后,再点燃另外一处的酒精灯。
(3)若没有装置C(其他均相同),则D中发生的主要副反应的化学方程式为__________。
(4)该实验装置存在设计缺陷,你的改进措施为______________________________。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取0.7500g锡粉溶于足量稀盐酸中,向生成的SnCl2溶液中加入过量的FeCl3溶液,用物质的量浓度为0.1000molL-1 K2Cr2O7标准溶液滴定生成的Fe2+(已知酸性环境下Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液的体积为20.00mL。
①锡粒中锡的质量分数_____。
②若溶解锡粉的过程生成的SnCl2溶液中含有Sn![]() ,则测定结果将__________(填“偏高”、“偏低”或“无影响”)
,则测定结果将__________(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,将33.6LHCl气体溶于50mL水再配成500mL溶液,求:
(1)所得盐酸的物质的量浓度为___________________。
(2)若将此溶液再加水稀释至1.5L,则稀释后盐酸的物质的量浓度为__________。
(3)将(2)的溶液取出1L与足量的石灰石反应,产生的CO2在标准状况下的体积为___________?(此问写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )

A.该实验说明氨气是一种极易溶于水的气体
B.进入烧瓶中的液体颜色由无色变为红色,说明氨水有碱性
C.氨水很稳定,将烧瓶中的红色溶液加热,颜色不会发生变化
D.形成“喷泉”的主要原因是氨气溶于水后,烧瓶内的气压小于大气压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应进行过程中,各物质物质的量的变化情况如图所示。下列说法正确的是
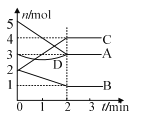
A. C、D是生成物
B. 反应的方程式为2A + B![]() 2C
2C
C. 2 min后各物质的量不再变化
D. 该反应不是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过测定反应过程中所放出的热量可计算中和热。50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:
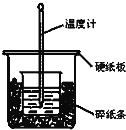
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是___________.
(2)大烧杯上如果不盖硬纸板,求得的中和热数值__________(填“偏大”,“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”“不相等”),简述理由:______________________.
(4)若两溶液的密度都是1g/mL,中和后所得溶液的比热容c=4.18J/(g·℃),三次平行操作测得终止温度与起始温度差(t2﹣t1)分别为:①3.2℃ ②2.2℃ ③3.0℃,写出表示盐酸与NaOH溶液反应的中和热的热化学方程式________________________.(小数点后保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3BrF3+5H2O===HBrO3+Br2+9HF+O2↑中,若有5 mol H2O作为还原剂时,被还原的BrF3的物质的量为( )
A. 3 mol B. 2 mol C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com