
【题目】微型实验具有装置小巧、节约药品、操作简便、现象明显、安全可靠、减少污染等优点,下图是某同学设计的实验室制取Cl2并探究其化学性质的微型装置(图中夹持装置均略去)。
查阅资料:氯气的氧化性大于HIO3。
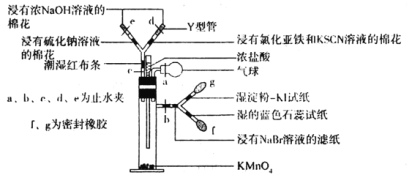
回答下列问题:
(1)实验室中可代替图中添加浓盐酸的仪器名称是___________。
(2)加入浓盐酸后试管内发生反应的化学方程式是__________________________________。
(3)探究氯气的化学性质,将实验现象填写在下表对应的空格里:___________
操作步骤 | 实验现象 |
缓慢加入浓盐酸,打开c、d、e,使产生的氯气缓慢充入Y试管 | |
关闭c打开b,使氯气缓慢进入Y管中 |
(4)实验中发现若氯气的通入量过多,淀粉碘化钾试纸会逐渐变为无色,可能的原因是__________________________________________________。
(5)此装置___________(填“能”或“不能”)证明氧化性顺序Cl2>Br2>I2,原因是___________,实验完毕后,关闭止水夹b,打开a、c,挤压气球,目的是__________________________。
【答案】分液漏斗 2KMnO4+16HCl(浓)=2KCl+5Cl2↑+2MnCl2+8H2O 潮湿的红色布条褪色;浸有Na2S溶液的棉花出现淡黄色的S;浸有氯化亚铁和KSCN溶液的棉花变为红色;浸有氢氧化钠溶液的棉花无明显现象 湿润的淀粉碘化钾试纸变为蓝色;浸有NaBr溶液的滤纸变为红棕色;浸有湿润的蓝色石蕊试纸变为红色;氯气过量,与水结合生成HCl和HClO,HClO具有漂白性 不能 该装置只能Cl2的氧化性强于Br2,Cl2的氧化性强于I2,但不能证明Br2的氧化性强于I2, 将装置内的氯气赶入Y型管,使其完全被吸收,减少污染
【解析】
(1)装置中可用分液漏斗滴加浓盐酸;
(2)浓盐酸与高锰酸钾溶液反应,生成氯化钾、氯气、氯化锰和水;
(3)打开c、d、e,氯气逐渐进入Y型管中,Cl2与水结合生成HCl和HClO,HClO具有漂白性,Cl2具有氧化性,能与Na2S发生氧化还原反应,能将Fe2+氧化为Fe3+,Cl2与NaOH发生反应,生成NaCl和NaClO;Cl2具有氧化性,能将I-氧化为I2,能将Br-氧化为Br2,Cl2与水结合生成HCl和HClO,石蕊遇酸变色;
(4)少量的氯气遇淀粉碘化钾试纸会变为蓝色,当氯气过量时,氯气与生成的I2反应生成HIO3;
(5)欲证明氧化性顺序Cl2>Br2>I2,需证明Cl2的氧化性强于Br2,Br2的氧化性强于I2;关闭止水夹b,打开a、c,挤压气球,可将气体全部压入Y型管中,与氢氧化钠、硫化钠、氯化亚铁等物质充分反应。
(1)实验室中可代替图中添加浓盐酸的仪器名称是分液漏斗;
(2)浓盐酸与高锰酸钾溶液反应,生成氯化钾、氯气、氯化锰和水,反应方程式为:2KMnO4+16HCl(浓)=2KCl+5Cl2↑+2MnCl2+8H2O;
(3)打开c、d、e,氯气逐渐进入Y型管中,Cl2与水结合生成HCl和HClO,HClO具有漂白性,Cl2具有氧化性,能与Na2S发生氧化还原反应,能将Fe2+氧化为Fe3+,Cl2与NaOH发生反应,生成NaCl和NaClO,因此可观察到潮湿的红色布条褪色;浸有Na2S溶液的棉花出现淡黄色的S;浸有氯化亚铁和KSCN溶液的棉花变为红色;浸有氢氧化钠溶液的棉花无明显现象; Cl2具有氧化性,能将I-氧化为I2,能将Br-氧化为Br2,Cl2与水结合生成HCl和HClO,石蕊遇酸变色,关闭c打开b,使氯气缓慢进入Y管中,可观察到湿润的淀粉碘化钾试纸变为蓝色;浸有NaBr溶液的滤纸变为黄色;浸有湿润的蓝色石蕊试纸变为红色最终褪色;
(4)少量的氯气遇淀粉碘化钾试纸会变为蓝色,当氯气过量时,氯气与水结合生成HCl和HClO,HClO具有漂白性,淀粉碘化钾逐渐变为无色;
(5)该装置只能Cl2的氧化性强于Br2,Cl2的氧化性强于I2,但不能证明Br2的氧化性强于I2,因此该装置不能证明氧化性顺序Cl2>Br2>I2;打开a、c,挤压气球,可将气体全部压入Y型管中,被氢氧化钠、硫化钠、氯化亚铁等物质充分吸收,可减少环境污染。


科目:高中化学 来源: 题型:
【题目】热化学碘硫循环可用于大规模制氢气,SO2水溶液还原I2和HI分解均是其中的主要反应。回答下列问题:
(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。
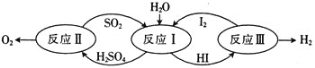
反应II包含两步反应:
①H2SO4(l)=SO3(g)+H2O(g) △H1=+177kJ/mol
②2SO3(g)=2SO2(g)+O2(g) △H2=+196kJ/mol
①写出反应①自发进行的条件是:________。
②写出反应Ⅱ的热化学方程式:________。
(2)起始时 HI的物质的量为1mo1,总压强为0.1MPa下,发生反应HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g) 平衡时各物质的物质的量随温度变化如图所示:
I2(g) 平衡时各物质的物质的量随温度变化如图所示:
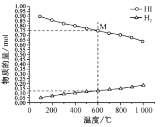
①该反应的△H ________ (“>”或“<”)0。
②600℃时,平衡分压p(I2)= ___MPa,反应的平衡常数Kp=______ (Kp为以分压表示的平衡常数)。
(3)反应 H2(g)+I2(g) ![]() 2HI(g)的反应机理如下:
2HI(g)的反应机理如下:
第一步:I2![]() 2I(快速平衡)
2I(快速平衡)
第二步:I+H2![]() H2I(快速平衡)
H2I(快速平衡)
第三步:H2I+I ![]() 2HI (慢反应)
2HI (慢反应)
①第一步反应_____ (填 “放出”或“吸收”)能量。
②只需一步完成的反应称为基元反应,基元反应如aA+dD = gG+hH 的速率方程,v= kca(A)cd(D),k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。H2(g)与I2(g)反应生成 HI(g)的速率方程为v= ____(用含k1、k-1、k2…的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数的数值,下列说法不正确的是
A.500mL 0.1mol/L的Na2SO4溶液中含Na+数目为0.1NA
B.标准状况下,11.2L H2O含有氧原子大于0.5NA
C.常温常压下,32 g氧气(O2)和臭氧(O3)的混合气体中含有的氧原子数为2NA
D.标准状况下,2.24 L N2和O2的混合气体中原子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在2020年抗击新型冠状病毒肺炎中被广泛用于消毒,其有效成分是NaClO。某校化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
已知:①室温下,饱和NaClO溶液pH为11
②25℃时,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11;HClO:Ka=3.0×10-8
I.制备NaClO溶液
该学习小组按下图装置进行实验(部分夹持装置省去)
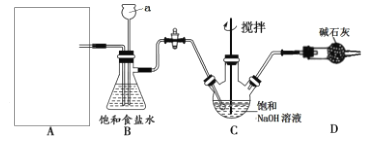
(1)上图中A为实验室制备Cl2的发生装置,可以选用下列图中_(填代号)装置,用该装置制备Cl2反应的化学方程式为__。
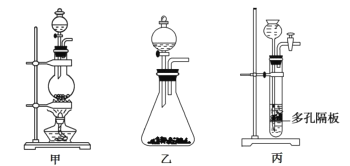
(2)B装置中仪器a的名称是____,B装置可除去氯气中氯化氢杂质, 此外还有______作用(写出一点)。
II.NaClO性质探究
按上图装置进行实验,一段时间后,取C瓶中的溶液进行实验,如下表:
实验内容 | 实验现象 | |
实验l | 取样,滴加紫色石蕊试液 | 变蓝,不褪色 |
实验2 | 测定溶液的pH | 12 |
(3)C瓶溶液中的溶质除NaCl外,还有______(填化学式)。
(4)将C瓶中NaOH溶液换成NaHCO3溶液,反应一段时间后,取C瓶中的溶液按上表实验内容进行实验。现象为:实验l中紫色石蕊试液立即褪色,实验2中溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因是________。
III.测定C瓶溶液中NaClO含量(单位:g·L-1)
i.取C瓶溶液10.00mL于锥形瓶中,加入适量硫酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
ii.用0.1000molL-1Na2S2O3标准溶液滴定上述锥形瓶中的溶液至终点,重复操作2~3次,消耗Na2S2O3溶液的平均用量为12.00mL。(已知:I2+2![]() =2I-+
=2I-+![]() )
)
(5)i中主要发生反应的离子方程式为_______,ii中用_______作指示剂。
(6)盖紧瓶塞并在暗处反应的原因是________。
(7)C瓶溶液中NaClO含量是______g·L-1(保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有a mol FeI2的溶液中,通入x mol Cl2。下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
A. x≤a,2I+Cl2=I2+2Cl
B. x=1.2a,10Fe2++14I+12Cl2=10Fe3++7I2+24Cl
C. x=1.4a,4Fe2++10I+7Cl2=4Fe3++5I2+14Cl
D. x≥1.5a,2Fe2++4I+3Cl2=2Fe3++2I2+6Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pc类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol/L,则该溶液溶质的pc=3。下列说法正确的是
A.25°C时,0.01mol/LNa2S水溶液中,pc(H+)+pc(OH-)=14
B.用0.01mol/L的NaOH溶液滴定某浓度的盐酸,滴定过程中pc(OH-)逐渐增大
C.某温度下,弱酸HB的Ka=1×10-5mol/L,则该溶液中pc(H+)+pc(B-)=l0
D.向0.0lmol/L的Ca(HCO3)2溶液中逐渐滴加烧碱溶液,滴加过程中pc(Ca2+)逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以铝土矿(含 Al2O3、Fe2O3和 SiO2)为原料进行炼铝探究(流程如下),叙述错误的是
![]()
A. 步骤①②过程中均需过滤操作
B. a、b中铝元素的化合价相同
C. 反应③的化学方程式为:2 NaAlO2+3H2O+CO2 = 2Al(OH)3↓+Na2CO3
D. d只能是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰是制造电信器材软磁铁氧体、合成二氧化锰和制造其它锰盐的原料,用于医药、电焊条辅助原料等。工业上用氯化铵焙烧菱锰矿粉制备高纯度碳酸锰的工艺流程如下:
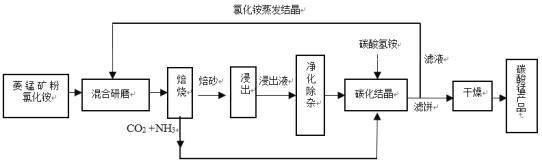
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子浓度c(Mn+)=0.1 mol L -1,形成M(OH)n沉淀的pH范围如下:
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
开始沉淀的pH | 6.3 | 1.5 | 3.8 | 8.8 | 9.6 |
沉淀完全的pH | 8.3 | 2.8 | 5.2 | 10.8 | 11.6 |
③常温下,Ksp(CaF2) =1.46×10-10,Ksp(MgF2) = 7.30×10-11
回答下列问题:
(1)混合研磨成细粉的目的是_________________。
(2)“焙烧”时发生的主要反应的化学方程式为_____________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________;再调节溶液pH范围为________将Al3+、Fe3+变为沉淀除去;再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5molL-1时,c(Mg2+)=______molL-1。
(4)碳化结晶过程中不能用(NH4)2CO3溶液代替NH4HCO3溶液可能的原因是_________。
(5)在操作流程中可以循环利用的物质是__________。
(6)测定碳酸锰产品的纯度。
称取0.2500g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至50 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2![]() )。重复操作3次,记录数据如下表:
)。重复操作3次,记录数据如下表:
滴定 次数 | 0.2000mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 10.20 |
2 | 0.22 | 11.32 |
3 | 1.05 | 10.95 |
则产品的纯度=____________,若滴定终点时俯视读数,则测得的碳酸锰粗产品的纯度__________。(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
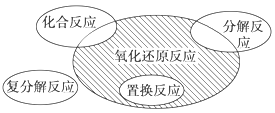
A.Cl2+2KBr=Br2+2KClB.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3D.2Na2O2+2CO2=2Na2CO3+O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com