
【题目】碳酸锰是制造电信器材软磁铁氧体、合成二氧化锰和制造其它锰盐的原料,用于医药、电焊条辅助原料等。工业上用氯化铵焙烧菱锰矿粉制备高纯度碳酸锰的工艺流程如下:
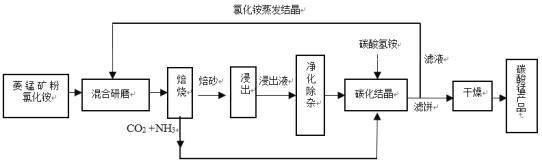
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子浓度c(Mn+)=0.1 mol L -1,形成M(OH)n沉淀的pH范围如下:
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
开始沉淀的pH | 6.3 | 1.5 | 3.8 | 8.8 | 9.6 |
沉淀完全的pH | 8.3 | 2.8 | 5.2 | 10.8 | 11.6 |
③常温下,Ksp(CaF2) =1.46×10-10,Ksp(MgF2) = 7.30×10-11
回答下列问题:
(1)混合研磨成细粉的目的是_________________。
(2)“焙烧”时发生的主要反应的化学方程式为_____________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________;再调节溶液pH范围为________将Al3+、Fe3+变为沉淀除去;再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5molL-1时,c(Mg2+)=______molL-1。
(4)碳化结晶过程中不能用(NH4)2CO3溶液代替NH4HCO3溶液可能的原因是_________。
(5)在操作流程中可以循环利用的物质是__________。
(6)测定碳酸锰产品的纯度。
称取0.2500g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至50 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2![]() )。重复操作3次,记录数据如下表:
)。重复操作3次,记录数据如下表:
滴定 次数 | 0.2000mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 10.20 |
2 | 0.22 | 11.32 |
3 | 1.05 | 10.95 |
则产品的纯度=____________,若滴定终点时俯视读数,则测得的碳酸锰粗产品的纯度__________。(填“偏高”、“偏低”或“无影响”)。
【答案】增大接触面积,提高反应速率 MnCO3+2NH4Cl ![]() MnCl2+2NH3↑+CO2↑+H2O MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O 5.2≤pH<8.8 5×10-6 碳酸根离子水解程度大,碳酸铵溶液中c(OH-)较大,易产生Mn(OH)2沉淀 NH4Cl 92.00% 偏低
MnCl2+2NH3↑+CO2↑+H2O MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O 5.2≤pH<8.8 5×10-6 碳酸根离子水解程度大,碳酸铵溶液中c(OH-)较大,易产生Mn(OH)2沉淀 NH4Cl 92.00% 偏低
【解析】
菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素,加入氯化铵混合研磨后、焙烧,此时发生反应,由流程图可知,MnCO3与NH4Cl反应生成NH3、CO2、氯化锰等,其它金属元素转化为金属氯化物;往浸出液中加入MnO2,将Fe2+氧化为Fe3+;再调节溶液pH范围,将Fe3+、Al3+转化为氢氧化物沉淀;再加入NH4F沉淀Ca2+、Mg2+;最后加碳酸氢铵,将Mn2+转化为MnCO3沉淀。
(1)混合研磨成细粉,可增大固体颗粒间的接触,从而得出目的是增大接触面积,提高反应速率。答案为:增大接触面积,提高反应速率;
(2)“焙烧”时,MnCO3与NH4Cl反应生成NH3、CO2、氯化锰等,发生的主要反应的化学方程式为MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O。答案为:MnCO3+2NH4Cl
MnCl2+2NH3↑+CO2↑+H2O。答案为:MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O;
MnCl2+2NH3↑+CO2↑+H2O;
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,而MnO2被还原为Mn2+,反应的离子方程式为MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O;再调节溶液pH范围,让Al3+、Fe3+全部生成沉淀,而Ca2+、Mg2+不生成沉淀,所以pH范围为5.2≤pH<8.8;再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5molL-1时,c(Mg2+)=![]() =
=![]() =5×10-6molL-1。答案为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O;5.2≤pH<8.8;5×10-6;
=5×10-6molL-1。答案为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O;5.2≤pH<8.8;5×10-6;
(4)碳化结晶过程中不能用(NH4)2CO3溶液代替NH4HCO3溶液,主要从![]() 溶液的碱性强,Mn2+会转化为锰的氢氧化物角度分析,可能的原因是碳酸根离子水解程度大,碳酸铵溶液中c(OH-)较大,易产生Mn(OH)2沉淀。答案为:碳酸根离子水解程度大,碳酸铵溶液中c(OH-)较大,易产生Mn(OH)2沉淀;
溶液的碱性强,Mn2+会转化为锰的氢氧化物角度分析,可能的原因是碳酸根离子水解程度大,碳酸铵溶液中c(OH-)较大,易产生Mn(OH)2沉淀。答案为:碳酸根离子水解程度大,碳酸铵溶液中c(OH-)较大,易产生Mn(OH)2沉淀;
(5)在操作流程中,反应物中加入了NH4Cl,分离滤液和滤饼时又获得了氯化铵,所以可以循环利用的物质是NH4Cl。 答案为:NH4Cl;
(6)测定碳酸锰产品的纯度时,3次滴定操作中的第2次误差过大,实验数据不能采用,由此可得出两次有效滴定所用标准溶液的平均体积为![]() =10.00mL,由反应可得出如下关系式:MnCO3——(NH4)2Fe(SO4)2,n
=10.00mL,由反应可得出如下关系式:MnCO3——(NH4)2Fe(SO4)2,n![]() =92.00%,若滴定终点时俯视读数,则读出的硫酸亚铁铵标准溶液的体积偏小,测得的碳酸锰粗产品的纯度偏低。答案为:92.00%;偏低。
=92.00%,若滴定终点时俯视读数,则读出的硫酸亚铁铵标准溶液的体积偏小,测得的碳酸锰粗产品的纯度偏低。答案为:92.00%;偏低。


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】已知:pAg=![]() lg[c(Ag+)],Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位:mL)变化的图像(实线)。根据图像所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]
lg[c(Ag+)],Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位:mL)变化的图像(实线)。根据图像所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]
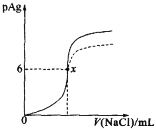
A.原AgNO3溶液的物质的量浓度为1mol·L-1
B.图中x点的坐标为(100,6)
C.图中x点可认为溶液中Ag+被沉淀完全
D.把0.1mol·L-1的NaCl换成0.1mol·L-1NaI,则图像在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型实验具有装置小巧、节约药品、操作简便、现象明显、安全可靠、减少污染等优点,下图是某同学设计的实验室制取Cl2并探究其化学性质的微型装置(图中夹持装置均略去)。
查阅资料:氯气的氧化性大于HIO3。
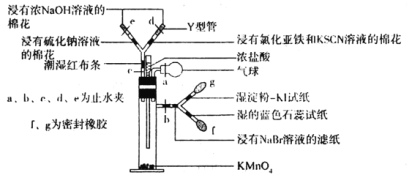
回答下列问题:
(1)实验室中可代替图中添加浓盐酸的仪器名称是___________。
(2)加入浓盐酸后试管内发生反应的化学方程式是__________________________________。
(3)探究氯气的化学性质,将实验现象填写在下表对应的空格里:___________
操作步骤 | 实验现象 |
缓慢加入浓盐酸,打开c、d、e,使产生的氯气缓慢充入Y试管 | |
关闭c打开b,使氯气缓慢进入Y管中 |
(4)实验中发现若氯气的通入量过多,淀粉碘化钾试纸会逐渐变为无色,可能的原因是__________________________________________________。
(5)此装置___________(填“能”或“不能”)证明氧化性顺序Cl2>Br2>I2,原因是___________,实验完毕后,关闭止水夹b,打开a、c,挤压气球,目的是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解NaHSO4溶液制备Na2S2O8(过二硫酸钠)。电解时,阴极材料为Pb;阳极(铂电极)电极反应式为2![]() -2e-=
-2e-=![]() +2H+。下列说法正确的是
+2H+。下列说法正确的是
A.Na2S2O8水溶液呈弱碱性
B.Na2S2O8可水解生成H2O2,同时生成NaHSO4可循环利用
C.H2S2O8可完全电离,故稳定性与硫酸相当
D.Na2S2O8具有强氧化性,故不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,发生_____(填“氧化”或“还原”)反应,则该反应的还原剂是________。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为____。
(3)根据上述反应可推知________(填序号)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>HBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。_____________
![]() +
+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H)。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
①比较下列两组物质的熔点高低(填“>”或“<”=)
SiC_____________Si;SiCl4_____________SiO2
②工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)该反应的反应热△H=_____________kJ/mol.
Si(s)+4HCl(g)该反应的反应热△H=_____________kJ/mol.
(2)已知化合物Na2O的晶胞如图。
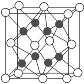
①其中O2-离子的配位数为________,
②该化合物与MgO相比,熔点较高的是________。(填化学式)
③已知该化合物的晶胞边长为apm,则该化合物的密度为___g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.向氨水中加入少量的硫酸氢钠,溶液碱性减弱
B.每升pH=3的H2C2O4 溶液中H+数目为0.003NA
C.常温下,CH3COONa溶液中加水,水电离产生的c(H+)、c(OH-)保持不变
D.0.1molFeCl3溶于水形成的Fe(OH)3胶体粒子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D1、D2、E、F、G、H均为有机化合物,请根据下列图示回答问题。
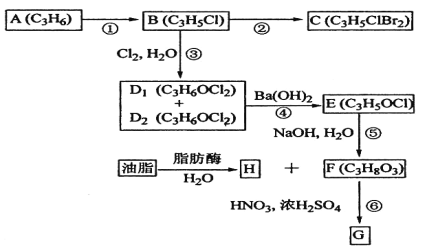
(1)直链有机化合物A的结构简式是__________________;
(2)B中官能团的名称为___________;
(3)①的反应试剂和反应条件是__________;
(4)D1或D2生成E的化学方程式是___________________________________;
(5)G可应用于医疗、爆破等,由F生成G的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL、0.2mol/LNaOH溶液中,缓缓通入一定量CO2气体,将溶液在一定条件下蒸干。
(1)若得到白色固体是纯净物,则通入的CO2的体积为__mL或__mL(标况)。写出有关的离子方程式:__、__。
(2)将上述白色固体加水溶解,加盐酸至pH=7再蒸干得白色固体质量为__g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com