
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.某无色澄清透明溶液中:K+ H+ Fe2+ Cl-
B.含0.1 mol·L-1OH-的溶液中:Na+ K+ ![]() ClO-
ClO-
C.含0.1 mol·L-1![]() 的溶液中:K+ Ca2+
的溶液中:K+ Ca2+ ![]()
![]()
D.含0.1 mol·L-1OH-的溶液中:Fe3+ ![]() Cu2+
Cu2+ ![]()
科目:高中化学 来源: 题型:
【题目】山萘酚(Kaempf erol)结构如下图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用。下列有关山萘酚的叙述正确的是 ( )
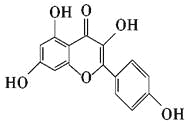
A. 结构式中含有羟基、醚键、酯基、碳碳双键
B. 可发生取代反应、水解反应、加成反应
C. 可与NaOH反应,不能与NaHCO3反应
D. 1 mol山萘酚与溴水反应最多可消耗4 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略)如图所示:
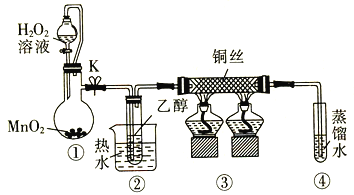
下列说法错误的是
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为2CH3CH2OH +O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出。再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用下列装置完成了探究浓硫酸和 SO2性质的实验(部分夹持装置已省略),下列“ 现象预测” 与“ 解释或结论” 均正确的是
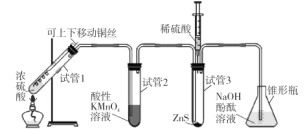
选项 | 仪器 | 现象预测 | 解释或结论 |
A | 试管1 | 有气泡、酸雾,溶液中有白色固体出现 | 酸雾是SO2所形成,白色固体是硫酸铜晶体 |
B | 试管2 | 紫红色溶液由深变浅,直至褪色 | SO2具有还原性 |
C | 试管3 | 注入稀硫酸后,没有现象 | 由于Ksp(ZnS)太小,SO2与ZnS在注入稀硫酸后仍不反应 |
D | 锥形瓶 | 溶液红色变浅 | NaOH溶液完全转化为NaHSO3溶液,NaHSO3溶液碱性小于NaOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、D、F均是常见元素组成的单质,B是淡黄色固体,常温下C是液体。
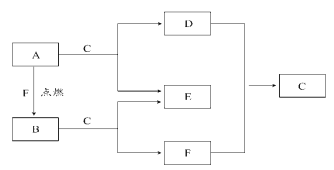
请回答下列问题:
(1)B和E的化学式:B__,E___。
(2)A与C反应的离子方程式为___;A与F生成B的化学方程式为___。
(3)关于A的叙述中正确的是___(填序号)。
①A有很强的还原性 ②A的焰色反应呈紫色
③少量A可以保存在冷水里 ④A着火时应用细沙盖灭
(4)将A、镁、铝各0.3mol分别放入100mL1mol/L的盐酸中,同温同压下产生的气体体积之比是__。
①1∶2∶3 ②6∶3∶2 ③3∶1∶1 ④1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=![]() lg[c(Ag+)],Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位:mL)变化的图像(实线)。根据图像所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]
lg[c(Ag+)],Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位:mL)变化的图像(实线)。根据图像所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]
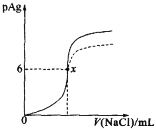
A.原AgNO3溶液的物质的量浓度为1mol·L-1
B.图中x点的坐标为(100,6)
C.图中x点可认为溶液中Ag+被沉淀完全
D.把0.1mol·L-1的NaCl换成0.1mol·L-1NaI,则图像在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯二氮卓类药物氟马西尼(F)的合成路线如下图所示。请回答下列问题:
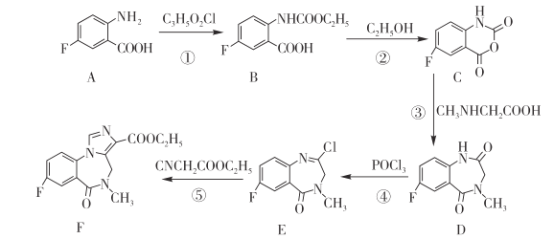
(1)A中官能团有氟原子、_____和________。(均填名称)
(2)C3H5O2Cl的结构式为________。
(3)反应①和②的反应类型相同,其反应类型是___________。
(4)化合物 D的分子式为___________。
(5)反应⑤生成“ 物质 F” 和 HCl,则 E→F的化学反应方程式为________。
(6)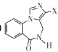 是 F的同分异构体,其中 X部分含—COOH且没有支链,满足该条件的同分异构体有______种(不考虑立体异构)。
是 F的同分异构体,其中 X部分含—COOH且没有支链,满足该条件的同分异构体有______种(不考虑立体异构)。
(7)已知氨基酸之间脱水能够形成含肽键的化合物,请设计由甘氨酸(HOOCCH2NH2)和CNCH2COOC2H5制备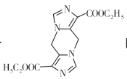 的合成路线________(无机试剂任选)。
的合成路线________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180.50kJ·mol-1
2NO(g) △H=+180.50kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) △H=–566.00kJ·mol-1
2CO2(g) △H=–566.00kJ·mol-1
(1)为了减轻大气污染,人们设想提出在汽车尾气排气管口将NO和CO转化成无污染气体参与大气循环。写出该反应的热化学方程式:_______________________________,该想法能否实现______(填“能”或“不能”)。
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化的关系如图甲所示。

①T℃时该化学反应的平衡常数K=_________,平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将_________(填“向左”“向右”或“不)移动。
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中,n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是________(填“a”或“b”)。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,发生_____(填“氧化”或“还原”)反应,则该反应的还原剂是________。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为____。
(3)根据上述反应可推知________(填序号)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>HBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。_____________
![]() +
+![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com