
| A. | 一定条件下,180g淀粉水解得到葡萄糖的分子数为NA | |
| B. | 1 mol C10H22分子中共价键总数为31 NA | |
| C. | 室温下,4.4 g乙醛和乙酸乙酯的混合物含有的碳原子数为0.2 NA | |
| D. | 88.0g干冰中含有的共用电子对对数为8NA |
分析 A.依据淀粉水解化学方程式计算;
B.C10H22是饱和烷烃,依据烷烃分子结构中 碳碳间,碳氢间都是单键计算共价键数;
C.乙醛和乙酸乙酯最简式相同为CH2O,只需计算4.4gCH2O中碳原子数即可;
D.依据n=$\frac{m}{M}$计算物质的量结合二氧化碳分子结构计算分析.
解答 解:A.淀粉水解化学反应的方程式
(C6H10O5)n+nH2O$\stackrel{稀硫酸}{→}$nC6H12O6,
162n n
162g 1mol
162g淀粉水解得到葡萄糖的分子数为NA,故A错误;
B.C10H22是饱和烷烃,依据烷烃分子结构中碳碳间都是单键计算共价键数=1mol×(10-1+22)×NA=31NA,故B正确;
C.乙醛和乙酸乙酯最简式相同为CH2O,只需计算4.4gC2H4O中碳原子数即可,4.4g乙醛和乙酸乙酯的混合物含有的碳原子数=$\frac{4.4g}{44g/mol}$×2×NA=0.2NA,故C正确;
D.依据n=$\frac{m}{M}$计算物质的量,结合二氧化碳分子中含有4个共用电子对,88.0g干冰物质的量为2mol,分子中含有的共用电子对对数为8NA,故D正确;
故选:A.
点评 本题考查了阿伏伽德罗常数的应用,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键.注意有机物结构特点,题目难度中等.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
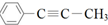 的描述正确的是( )
的描述正确的是( )| A. | 该有机物中只含有非极性键 | |
| B. | 该有机物与溴水的加成产物只有1种 | |
| C. | 该分子中最多有10个原子共平面 | |
| D. | 该分子中最多有5个碳原子共直线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
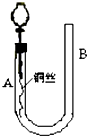 为了说明稀硝酸与铜反应产生无色的一氧化氮气体,某同学设计了如图所示的实验装置.实验时,将分液漏斗的活塞打开,从U形管的长管口B注入稀硝酸,一直到U形管的短管口A单孔塞下沿且液面不再留有气泡为止.关闭活塞,并用酒精灯在U形管短管下微热.当铜丝上有气泡产生时,立即撤去酒精灯.试回答:
为了说明稀硝酸与铜反应产生无色的一氧化氮气体,某同学设计了如图所示的实验装置.实验时,将分液漏斗的活塞打开,从U形管的长管口B注入稀硝酸,一直到U形管的短管口A单孔塞下沿且液面不再留有气泡为止.关闭活塞,并用酒精灯在U形管短管下微热.当铜丝上有气泡产生时,立即撤去酒精灯.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
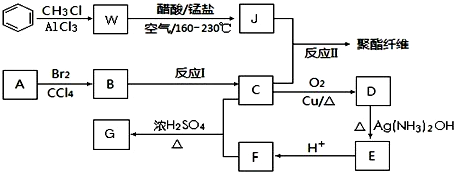
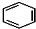 +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$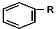 +HCl(-R为烃基)
+HCl(-R为烃基)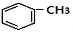 $→_{空气/160-230℃}^{醋酸/锰盐}$
$→_{空气/160-230℃}^{醋酸/锰盐}$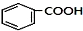
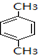 .
.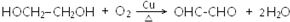 .
.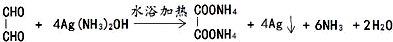 .
.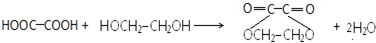 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 化学反应的速率和限度均可通过改变化学反应条件而改变 | |
| C. | 可逆反应只是代表少数反应 | |
| D. | 化学反应达到平衡状态时,正反应速率与逆反应速率相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com