
【题目】下列有关说法中,不正确的是![]()
A.![]() 的HCN溶液与
的HCN溶液与![]() 的NaOH溶液等体积混合,所得溶液中
的NaOH溶液等体积混合,所得溶液中![]() ,则a一定小于b
,则a一定小于b
B.常温下,![]() 溶液的
溶液的![]() ,则
,则![]()
C.常温下,![]() 的某酸溶液中,若
的某酸溶液中,若![]() ,则溶液中由水电离出的
,则溶液中由水电离出的![]()
D.在![]() 的
的![]() 溶液中加入少量NaOH固体,
溶液中加入少量NaOH固体,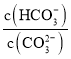 减小
减小
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
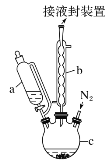
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等,广泛应用于航天、化工等领域中。实验室制备二茂铁的装置示意图如图所示:
已知:Ⅰ.二茂铁熔点是173 ℃,在100℃时开始升华;沸点是249℃。
Ⅱ.制备二茂铁的反应原理是:2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O。
实验步骤为:
①在三颈烧瓶中加入25 g粉末状的KOH,并从仪器a中加入60 mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10 min;
②再从仪器a滴入5.5 mL新蒸馏的环戊二烯(C5H6,密度为0.95 g·cm-3),搅拌;
③将6.5 g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25 mL装入仪器a中,慢慢滴入仪器c中,45 min滴完,继续搅拌45 min;
④再从仪器a加入25 mL无水乙醚搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器c的名称是______。和普通分液漏斗相比,使用恒压滴液漏斗a的优点是______。
(2)步骤①中通入氮气的作用是_________。
(3)步骤⑤用盐酸洗涤的目的是_________。
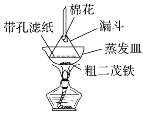
(4)步骤⑦是二茂铁粗产品的提纯,该过程在如图装置中进行,其操作名称为__________;为了确认得到的是二茂铁,还需要进行的一项简单实验是__________;
(5)若最终制得纯净的二茂铁4.3 g,则该实验的产率为________(保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度容积相同的3个密闭容器中,按不同方式投入反应物并保持恒温恒容,测得反应达到平衡时的有关数据如下![]() 已知:
已知:![]()
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol | 2mol | 4mol |
|
|
|
|
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
体系压强 |
|
|
|
反应物转化率 |
|
|
|
下列说法正确的是
A.![]() B.
B.![]() C.2
C.2![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一密闭容器中进行,下列说法正确是
CO(g)+H2(g)在一密闭容器中进行,下列说法正确是
A.保持容器体积不变,增加C的物质的量,反应速率增大
B.保持容器体积不变,充入N2容器内气体压强增大,化学反应速率增大
C.保持压强不变,充入N2容器内气体压强不变,化学反应速率减小
D.保持容器体积不变,随着反应进行气体物质的量增多,压强增大,反应速率逐渐加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1000 molL-1的H2A溶液中,逐滴滴加0.1000 molL-1的NaOH 溶液,混合溶液PH随加入NaOH溶液体积的变化如图所示。下列说法正确的是
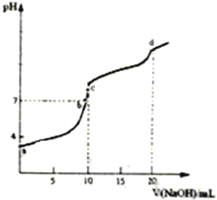
A.在a、b、c、d 四点中,由水电离出的c(H+)·c(OH-)不变
B.b点溶液存在关系:c(OH-)=c(H+)+c(H2A)-c(A2-)
C.C 点溶液中:c(Na+)>c(HA-)>c(OH-)>c(H2A)> c(H+)>c(A2-)
D.d 点溶液中: 2c(Na+)=c(HA-)+ C(A2-)+ c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 pOH=-lgc(OH-)。向20mL0.1mol·L-1 的氨水中滴加未知浓度的稀 H2SO4,测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法不正确的是( )

A.稀H2SO4 的物质的量浓度为0.05mol·L-1
B.当溶液中pH=pOH时,水的电离程度最大
C.a点时溶液中存在[NH3·H2O]+2[OH-]=[NH4+]+2[H+]
D.a、b、c 三点对应 NH4+的水解平衡常数:Kh(b)>Kh(a)>Kh(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
平衡时n(C)/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是( )
A.K1=K2<K3
B.升高温度能加快反应速率的原因是降低了反应的活化能
C.实验Ⅱ比实验Ⅰ达平衡所需时间小的可能原因是使用了催化剂
D.实验Ⅲ达平衡后,恒温下再向容器中通入1molA和1molC,平衡正向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com