
【题目】已知 pOH=-lgc(OH-)。向20mL0.1mol·L-1 的氨水中滴加未知浓度的稀 H2SO4,测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法不正确的是( )

A.稀H2SO4 的物质的量浓度为0.05mol·L-1
B.当溶液中pH=pOH时,水的电离程度最大
C.a点时溶液中存在[NH3·H2O]+2[OH-]=[NH4+]+2[H+]
D.a、b、c 三点对应 NH4+的水解平衡常数:Kh(b)>Kh(a)>Kh(c)
【答案】B
【解析】
向20mL0.1mol·L-1 的氨水中滴加未知浓度的稀 H2SO4,反应放热,溶液的温度升高,当二者恰好完全反应,放热最多,溶液的温度最高,所以硫酸的体积为20mL时,恰好完全反应。
A.20mL0.1mol·L-1 的氨水中含有一水合氨的物质的量为0.1 mol·L-1×0.02L=0.002mol,硫酸的体积为20mL时,恰好完全反应,则消耗硫酸的物质的量为0.001mol,该硫酸的物质的量为0.001 mol /0.02L=0.05mol/L,故正确;
B.当溶液中的pH=pOH时,溶液为中性,此时溶质为硫酸铵和氨水,铵根离子的水解程度与氨水的电离程度相等,水的电离几乎没有影响,当氨水与硫酸恰好反应生成硫酸铵时,即b点时,铵根离子水解,促进了水的电离,此时水的电离程度最大,故错误;
C.a点加入10mL等浓度的氨水,反应后溶质为一水合氨和硫酸铵,且一水合氨为硫酸铵浓度的2倍,根据电荷守恒可得:[NH4+] +[H+]= 2[SO42-]+[OH-],根据物料守恒可得:[NH3·H2O]+ [NH4+]= 4[SO42-],二者结合可得:[NH3·H2O]+2[OH-]=[NH4+]+2[H+],故正确;
D.升高温度促进氨水的电离,电离常数增大,由图可知,温度:b>a>c,则a、b、c三点氨水的电离常数Kh(b)>Kh(a)>Kh(c),故正确。
故选B。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】化合物Y能用于高性能光学树脂的合成,可由化合物X与2-甲基丙烯酰氯在一定条件下反应制得:( )
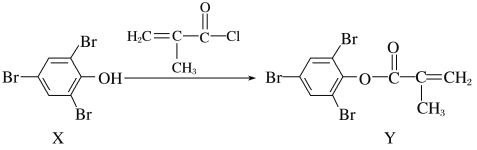
下列有关化合物X、Y的说法正确的是( )
A.X→Y的反应为加成反应
B.X分子中所有原子一定在同一平面上
C.X、Y均不能使酸性KMnO4溶液褪色
D.Y与Br2加成产物分子中含有手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中,不正确的是![]()
A.![]() 的HCN溶液与
的HCN溶液与![]() 的NaOH溶液等体积混合,所得溶液中
的NaOH溶液等体积混合,所得溶液中![]() ,则a一定小于b
,则a一定小于b
B.常温下,![]() 溶液的
溶液的![]() ,则
,则![]()
C.常温下,![]() 的某酸溶液中,若
的某酸溶液中,若![]() ,则溶液中由水电离出的
,则溶液中由水电离出的![]()
D.在![]() 的
的![]() 溶液中加入少量NaOH固体,
溶液中加入少量NaOH固体,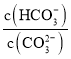 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新合成的某有机物A的结构简式如图,它含有1个手性碳原子,具有光学活性。若要使A通过反应失去光学活性,则发生的反应类型不可能是( )

A. 酯化反应 B. 水解反应 C. 银镜反应 D. 加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2 可用于合成多种化工原料。用 CO2 生产绿色燃料甲醇时发生反应A: CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1
(1)反应 A 的平衡常数表达式是_____。在恒温恒容的密闭容器中进行该反应,下列说法正确的是_____(填字母)。
A.反应达到平衡时,容器的总压强不再改变
B.加入合适的催化剂,可以提高 CO2 的转化率
C.将初始投料增加 1 倍,可以提高CO2 的转化率
D.充入一定量的He 气,可以提高CO2 的转化率
(2)在体积为 1 L 的恒容密闭容器中发生反应 A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对 CO2 平衡转化率影响的曲线。

① 反应 A 的ΔH1_____0(填“>”或“<”)。
② 曲线 c 对应的投料是_____。
③ T1℃时,曲线c 对应的化学平衡常数_____1(填“大于”、“小于”或“等于”)。
(3)在一定条件下,利用 CO2 合成 CH3OH 的反应过程中会有副反应:CO2(g) + H2(g)CO(g) + H2O(g)。压强一定时,将初始投料比一定的 CO2 和H2 按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 CH3OH、CO 的产率影响如图 1 所示,温度对 CO2 的转化率影响如图 2 所示。

由图像可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是_____。
(4)以 CO2 和 H2O 为原料合成 CH4,可以借助氮化镓(GaN)与 Cu 组成的人工光合系统, 装置如图所示。

① GaN 电极上的电极反应式是_____。
② 当有 0.4mol 电子转移时,铜电极上生成的CH4在标准状况下的体积是_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金(含铁)空心球为吸收剂的太阳能吸热涂层,铁、镍基态原子未成对电子数各为_____________、________________。
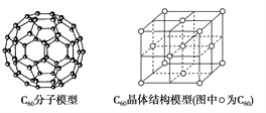
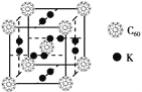
(2)C60可用作储氢材料,已知金刚石中的C-C键的键长为0.154 nm,C60中C-C键键长为0.140~0.145 nm,有同学据此认为C60的熔点高于金刚石,你认为是否正确?_________,阐述理由:________________________________________________________________________。C60晶体(其结构模型如图)中每个C60分子周围与它距离最近且等距离的C60分子有_____个。
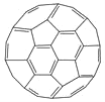
(3)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如下图所示,分子中碳原子轨道的杂化类型为_________;1 mol C60分子中σ键的数目为________。科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为________。
(4)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是______________。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为______个。
(5)请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量: N60>C60>Si60,其原因是:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx等挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g) ![]() CO2(g)+2H2O(g)+N2 (g) △H=____kJ·mol-1;该反应在________(高温,低温,任何温度)下可自发进行
CO2(g)+2H2O(g)+N2 (g) △H=____kJ·mol-1;该反应在________(高温,低温,任何温度)下可自发进行
(2)若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如下图所示。
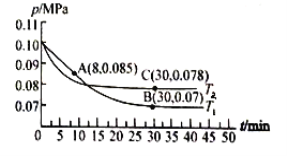
①图中A点时,SO2的转化率为________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率![]() 0(正)与A点的逆反应速率
0(正)与A点的逆反应速率![]() A(逆)的大小关系为
A(逆)的大小关系为![]() 0(正)_____
0(正)_____![]() A(逆) (填“>"、“<”或“ = ”)。
A(逆) (填“>"、“<”或“ = ”)。
③图中B点的平衡常数Kp=__________(MPa)-1。(Kp=压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为 90s 的情况下,测得不同条件下 NO 的脱氮率如图Ⅰ、Ⅱ所示。
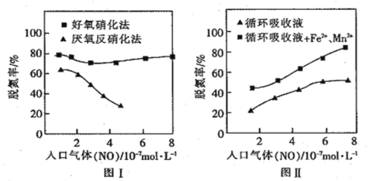
①由图I知,当废气中的NO含量增加时,宜选用______________法提高脱氮效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,其可能原因为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四个图像的说法中,正确的是( )


A.图甲表示向乙酸溶液中通入NH3过程中溶液导电性的变化
B.由图乙可知,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右
C.图丙表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化
D.图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究铝电极在原电池中的作用,在常温下,设计并进行了以下一系列实验,实验结果记录如下。
编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
① |
| 稀盐酸 | 偏向 |
② |
| 稀盐酸 | 偏向 |
③ |
| 稀盐酸 | 偏向石墨 |
④ |
| 氢氧化钠溶液 | 偏向 |
⑤ |
| 浓硝酸 | 偏向 |
试根据表中的电流表指针偏转方向回答下列问题:
(1)实验1、2中![]() 所作的电极(正极或负极)是否相同?________(填“相同”或“不相同”)。
所作的电极(正极或负极)是否相同?________(填“相同”或“不相同”)。
(2)由实验3完成下列填空:
①铝为________极,电极反应式为________________;
②石墨为________极,电极反应式为________________;
③电池总反应为________。
(3)实验4中铝作负极还是正极?________,理由是_______。写出铝电极的电极反应式:_______。
(4)解释实验5中电流表指针偏向铝的原因:_________。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com