
【题目】化合物Y能用于高性能光学树脂的合成,可由化合物X与2-甲基丙烯酰氯在一定条件下反应制得:( )
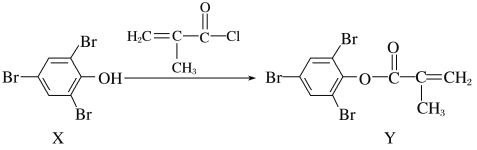
下列有关化合物X、Y的说法正确的是( )
A.X→Y的反应为加成反应
B.X分子中所有原子一定在同一平面上
C.X、Y均不能使酸性KMnO4溶液褪色
D.Y与Br2加成产物分子中含有手性碳原子
【答案】D
【解析】
A.由反应可知,反应中X的-OH上的H原子被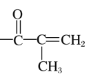 所取代生成了Y、同时生成了HCl,所以X→Y的反应为取代反应,A选项错误;
所取代生成了Y、同时生成了HCl,所以X→Y的反应为取代反应,A选项错误;
B.苯分子中所有原子共平面,共价单键可以旋转,所以O-H键旋转后导致-OH中的H原子与苯环不一定共平面,B选项错误;
C.含有碳碳不饱和键、酚羟基的有机物都能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,X中含有酚羟基,Y中含有碳碳双键,所以X、Y均能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,C选项错误;
D.Y与溴发生加成反应后,连接甲基的碳原子上含有4个不同原子或原子团,所以Y与溴发生加成反应后的产物中连接甲基的碳原子为手性碳原子,D选项正确;
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】写出下列反应的方程式或离子方程式:
(1)工业制粗硅的反应方程式:___;
(2)铜与氯化铁溶液的离子方程式:___;
(3)氧化铁和氢碘酸溶液反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L1·min1
B. 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C. 该温度,反应的平衡常数为11.25L·mol-1
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-氨基-3-氯苯甲酸(F)是重要的医药中间体,其制备流程图如图:
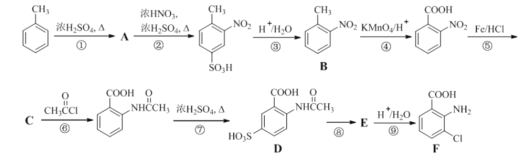
已知:![]()
![]()
![]()
回答下列问题:
(1)![]() 分子中不同化学环境的氢原子共有_______种,共面原子数目最多为_________。
分子中不同化学环境的氢原子共有_______种,共面原子数目最多为_________。
(2)写出⑧的反应试剂和条件______________;F中含氧官能团的名称为__________。
(3)该流程未采用甲苯直接硝化的方法制备B,而是经由①②③三步反应制取B,其目的是__________。
(4)写出⑥的化学反应方程式_______。
(5)B的名称为_________。写出符合下列条件B的所有同分异构体的结构简式________。
a.苯环上只有两个取代基且互为邻位
b.既能发生银镜反应又能发生水解反应
(6)请写出以 为主要原料,经最少步骤制备含酰胺键(结构与肽键相同)聚合物的流程_____。
为主要原料,经最少步骤制备含酰胺键(结构与肽键相同)聚合物的流程_____。 ……
……![]() 目标化合物
目标化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等,广泛应用于航天、化工等领域中。实验室制备二茂铁的装置示意图如图所示:
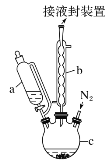
已知:Ⅰ.二茂铁熔点是173 ℃,在100℃时开始升华;沸点是249℃。
Ⅱ.制备二茂铁的反应原理是:2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O。
实验步骤为:
①在三颈烧瓶中加入25 g粉末状的KOH,并从仪器a中加入60 mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10 min;
②再从仪器a滴入5.5 mL新蒸馏的环戊二烯(C5H6,密度为0.95 g·cm-3),搅拌;
③将6.5 g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25 mL装入仪器a中,慢慢滴入仪器c中,45 min滴完,继续搅拌45 min;
④再从仪器a加入25 mL无水乙醚搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器c的名称是______。和普通分液漏斗相比,使用恒压滴液漏斗a的优点是______。
(2)步骤①中通入氮气的作用是_________。
(3)步骤⑤用盐酸洗涤的目的是_________。
(4)步骤⑦是二茂铁粗产品的提纯,该过程在如图装置中进行,其操作名称为__________;为了确认得到的是二茂铁,还需要进行的一项简单实验是__________;
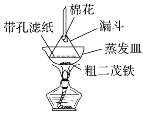
(5)若最终制得纯净的二茂铁4.3 g,则该实验的产率为________(保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度容积相同的3个密闭容器中,按不同方式投入反应物并保持恒温恒容,测得反应达到平衡时的有关数据如下![]() 已知:
已知:![]()
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol | 2mol | 4mol |
|
|
|
|
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
体系压强 |
|
|
|
反应物转化率 |
|
|
|
下列说法正确的是
A.![]() B.
B.![]() C.2
C.2![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 pOH=-lgc(OH-)。向20mL0.1mol·L-1 的氨水中滴加未知浓度的稀 H2SO4,测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法不正确的是( )

A.稀H2SO4 的物质的量浓度为0.05mol·L-1
B.当溶液中pH=pOH时,水的电离程度最大
C.a点时溶液中存在[NH3·H2O]+2[OH-]=[NH4+]+2[H+]
D.a、b、c 三点对应 NH4+的水解平衡常数:Kh(b)>Kh(a)>Kh(c)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com