
【题目】写出下列反应的方程式或离子方程式:
(1)工业制粗硅的反应方程式:___;
(2)铜与氯化铁溶液的离子方程式:___;
(3)氧化铁和氢碘酸溶液反应的离子方程式:___。
【答案】SiO2+2C![]() 2CO↑+Si Cu+2Fe3+=Cu2++2Fe2+ Fe2O3+2I-+6H+=2Fe2++I2+3H2O
2CO↑+Si Cu+2Fe3+=Cu2++2Fe2+ Fe2O3+2I-+6H+=2Fe2++I2+3H2O
【解析】
(1)工业上用焦炭还原二氧化硅制备粗硅,反应方程式为:SiO2+2C![]() 2CO↑+Si;
2CO↑+Si;
答案为: SiO2+2C![]() 2CO↑+Si;
2CO↑+Si;
(2)铜与氯化铁溶液反应时,铜做还原剂,三价铁离子做氧化剂,离子方程式为:Cu+2Fe3+=Cu2++2Fe3+;
答案为:Cu+2Fe3+=Cu2++2Fe2+;
(3)氧化铁和氢碘酸溶液反应,氧化铁做氧化剂,氢碘酸做还原剂,离子方程式为:Fe2O3+2I-+6H+=2Fe2++I2+3H2O;
答案为:Fe2O3+2I-+6H+=2Fe2++I2+3H2O。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】某同学运用电解原理实现在铁棒上镀铜,设计如图装置,下列判断不正确是

A.a 是铁B.液体 c 可用硫酸铜溶液
C.该实验过程中c Cu2+变小D.b 上发生反应的方程式为 Cu-2e-= Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放(1)已知重整过程中部分反应的热化方程式为:
①CH4(g)=C(s)+2H2(g) ΔH>0
②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH>0
③CO(g)+H2(g)=C(s)+H2O(g) ΔH<0
固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。

同温度下CO2的平衡转化率________(填“大于”“小于”或“等于”)CH4的平衡转化率。
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g) ![]() 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①![]()
![]() ,②
,②![]()
![]() 。下列结论正确的是
。下列结论正确的是
A.碳的燃烧热大于110.5 kJ·mol1
B.①的反应热为221 kJ·mol1
C.浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3 kJ热量
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]() 。下列说法正确的( )
。下列说法正确的( )
A.在相同条件下,1mol![]() 与1mol
与1mol![]() 的能量总和大于2mol
的能量总和大于2mol![]() 的能量
的能量
B.1mol![]() 与1mol
与1mol ![]() 反应生成2 mol液态HF放出的热量小于270kJ
反应生成2 mol液态HF放出的热量小于270kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用下图来表示

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室利用下图装置制备亚硝酸钠,并测定所制亚硝酸钠的纯度。(加热装置及部分夹持装置已略去)
Ⅰ.亚硝酸钠的制备。
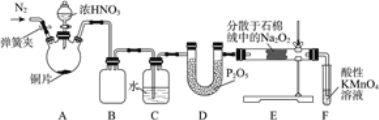
(1)盛放浓HNO3的仪器的名称为__________;装置B的作用是______________。
(2)装置E中制取NaNO2的化学方程式为___________________。
(3)多余的NO在装置F中被氧化为NO3-,反应的离子方程式为_____________。
(4)实验结束后打开A中弹簧夹,通入N2的目的是_______________。
Ⅱ.亚硝酸钠纯度的测定。
当Na2O2完全反应后,E中产生的固体除NaNO2外,还可能有NaNO3。测定亚硝酸钠纯度的步骤如下:
步骤一:取反应后的固体4.30 g溶于稀硫酸,向所得溶液中加入足量KI,将溶液中的NO2-和NO3-全部还原为NO,并通入足量N2,将NO全部赶出,最后将溶液稀释至1000 mL。
步骤二:取上述所得溶液10 mL,用淀粉作指示剂,用0.050 mol/L的Na2S2O3标准液滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,最终消耗Na2S2O3溶液体积为16.00 mL。
(5)步骤二中达到滴定终点的标志为______________________。
(6)混合固体中NaNO2的质量分数为________。(保留三位有效数字)
(7)若在滴定终点读取滴定管刻度时,仰视标准液液面,则测得亚硝酸钠的纯度________。(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
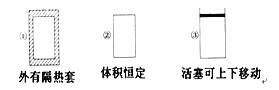
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列叙述正确的是
A.稀释pH=3的醋酸溶液,溶液中所有离子的浓度均降低
B.一定浓度的CH3COOH和NaOH溶液混合,溶液呈中性,则混合液中![]()
C.pH均为11的NaOH和Na2CO3溶液中,水的电离程度相同
D.分别中和pH与体积相同的硫酸和醋酸溶液,硫酸消耗氢氧化钠的物质的量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y能用于高性能光学树脂的合成,可由化合物X与2-甲基丙烯酰氯在一定条件下反应制得:( )
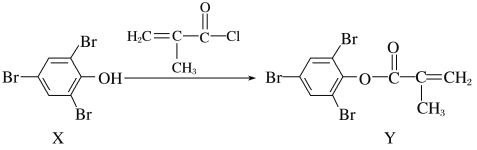
下列有关化合物X、Y的说法正确的是( )
A.X→Y的反应为加成反应
B.X分子中所有原子一定在同一平面上
C.X、Y均不能使酸性KMnO4溶液褪色
D.Y与Br2加成产物分子中含有手性碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com