
����Ŀ����1������CO2��CH4�����������Ի�úϳ�������Ҫ�ɷ�ΪCO��H2�������ɼ�������������ŷţ�1����֪���������в��ַ�Ӧ���Ȼ�����ʽΪ��
��CH4��g��=C��s��+2H2��g�� ��H>0
��CO2��g��+H2��g��=CO��g��+H2O��g�� ��H>0
��CO��g��+H2��g��=C��s��+H2O��g�� ��H<0
�̶�n��CO2��=n��CH4�����ı䷴Ӧ�¶ȣ�CO2��CH4��ƽ��ת���ʼ�ͼ�ס�

ͬ�¶���CO2��ƽ��ת����________��������������С����������������CH4��ƽ��ת���ʡ�
��2�����ܱ�������ͨ�����ʵ�����Ϊ0.1mol��CH4��CO2����һ�������·�����ӦCO2��g�� + CH4��g�� ![]() 2CO��g�� + 2H2��g����CH4��ƽ��ת�������¶ȼ�ѹǿ����λPa���Ĺ�ϵ��ͼ����ʾ��y�㣺v������_____v���棩��������������С��������������������֪�����ѹ��p����=������ѹ��p��������������ʵ�����������ƽ���ѹ����ƽ��Ũ�ȿ��Եõ�ƽ�ⳣ��Kp����x���Ӧ�¶��·�Ӧ��ƽ�ⳣ��Kp=__________________��
2CO��g�� + 2H2��g����CH4��ƽ��ת�������¶ȼ�ѹǿ����λPa���Ĺ�ϵ��ͼ����ʾ��y�㣺v������_____v���棩��������������С��������������������֪�����ѹ��p����=������ѹ��p��������������ʵ�����������ƽ���ѹ����ƽ��Ũ�ȿ��Եõ�ƽ�ⳣ��Kp����x���Ӧ�¶��·�Ӧ��ƽ�ⳣ��Kp=__________________��
���𰸡����� ���� ![]()
��������
��1������ͼʾ���Կ�����CO2��������������Ӧ��
��2���ٷ�ӦCO2��g��+CH4��g��![]() 2CO��g��+2H2��g���Ǹ������������ķ�Ӧ������ѹǿ�Ի�ѧƽ���Ӱ������
2CO��g��+2H2��g���Ǹ������������ķ�Ӧ������ѹǿ�Ի�ѧƽ���Ӱ������
��CO2��g��+CH4��g��![]() 2CO��g��+2H2��g������������ʽ����ƽ��ʱ��������ʵ���������ѹǿ֮�ȵ������ʵ���֮�ȼ���ƽ��ʱ��ѹǿ���ټ������ַ�ѹ������Kp=
2CO��g��+2H2��g������������ʽ����ƽ��ʱ��������ʵ���������ѹǿ֮�ȵ������ʵ���֮�ȼ���ƽ��ʱ��ѹǿ���ټ������ַ�ѹ������Kp=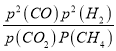 ���㣻
���㣻
��1������ͼʾ���Կ�����CO2��������������Ӧ��ͬ�¶���CO2��ƽ��ת���ʴ���CH4��ƽ��ת���ʣ��ʴ�Ϊ�����ڣ�
��2����ӦCO2��g��+CH4��g��![]() 2CO��g��+2H2��g���Ǹ������������ķ�Ӧ��ѹǿԽ��CH4��ת����ԽС����ͼ��֪��ͬ�¶��£�P1�����µ�ת���ʴ���P2����P1С��P2��ѹǿΪP2ʱ����Y�㷴Ӧδ�ﵽƽ�⣬��Ӧ�����ƶ�������v��������v���棩����ͼ֪�����¶���X����������ƽ��ʱ�����ת����Ϊ50%��������ʽ��
2CO��g��+2H2��g���Ǹ������������ķ�Ӧ��ѹǿԽ��CH4��ת����ԽС����ͼ��֪��ͬ�¶��£�P1�����µ�ת���ʴ���P2����P1С��P2��ѹǿΪP2ʱ����Y�㷴Ӧδ�ﵽƽ�⣬��Ӧ�����ƶ�������v��������v���棩����ͼ֪�����¶���X����������ƽ��ʱ�����ת����Ϊ50%��������ʽ��
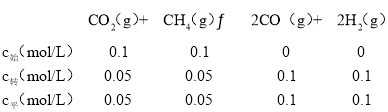
�����ʵ���=0.3mol����ѹΪP2����ƽ�ⳣ��Kp=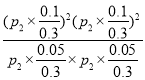 =
=![]() ��
��
�ʴ�Ϊ�����ڣ�![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����25����1.01��105Paʱ��16g����������������г��ȼ�����ɶ����������壬�ų�148.5kJ����������S��ȼ���ȵ��Ȼ�ѧ����ʽΪ��_____________________��
��2��1L 1mol/Lϡ�����1L 1mol/L NaOH��Һ���кͷ�Ӧ�ų�57.3kJ���������к��ȵ��Ȼ�ѧ����Ϊ��________________��
��3����֪��ͼ��ʾ�Ŀ��淴Ӧ��

��A(g)+B(g)![]() 2C(g) +D(g)����H = Q kJ/mol��Q_______0������>������<������=����
2C(g) +D(g)����H = Q kJ/mol��Q_______0������>������<������=����
����Ӧ��ϵ�м����������Ӧ����������E1�ı仯�ǣ� E1_______����H�ı仯�ǣ���H________����������������С��������������
��4������������![]() ��ȼ�ϣ�
��ȼ�ϣ�![]() �������������߷�Ӧ����N2��ˮ��������֪��N2(g) ��2O2��g���� 2NO2(g)��H1 ����67.7kJ/mol;N2H4��g����O2��g���� N2��g����2H2O��g�� ��H2����534kJ/mol,��1mol�����º�NO2��ȫ��Ӧʱ�ķ�Ӧ����H=____________kJ/mol��
�������������߷�Ӧ����N2��ˮ��������֪��N2(g) ��2O2��g���� 2NO2(g)��H1 ����67.7kJ/mol;N2H4��g����O2��g���� N2��g����2H2O��g�� ��H2����534kJ/mol,��1mol�����º�NO2��ȫ��Ӧʱ�ķ�Ӧ����H=____________kJ/mol��
��5����ӦA+3B=2C+2D�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ��
����v��A��=0.15mol/��Ls�� ����v��B��=0.6mol/��Ls������v��C��=0.4mol/��Ls�� ����v��D��=0.45mol/��Ls����÷�Ӧ��������Ϊ________������ţ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. Na2O2����ʪ�����ɫʯ����ֽ��ʯ����ֽ���ձ����ɫ
B. Na2O2��CO2��Ӧ����0.1 mol O2ʱת�Ƶ���0.4 mol
C. Na2O2Ͷ�뵽CuCl2��Һ������ɫ���������ݲ���
D. ���ռ���Һ�м���2 g Na2O2����ַ�Ӧ�����Һ��c(Na��)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3(g)��5O2(g)![]() 4NO(g) ��6H2O (g)������������ȷ���ǣ� ��
4NO(g) ��6H2O (g)������������ȷ���ǣ� ��
A.��Ӧ�ﵽƽ��ʱ�������ַ�Ӧ���ת������ȣ�����ʼͶ���n(NH3)��n(O2)=4:5
B.��Ӧ�ﵽƽ�����ϵһֱ���м�ѹ��ƽ�����������ƶ�
C.��Ӧ�ﵽƽ��ʱ������ѹǿ�̶����ܱ������г���ϡ�����壬ƽ�ⲻ�ƶ�
D.��v��(NH3)��v��(NO) =1:1ʱ��˵���û�ѧ��Ӧ�Ѿ��ﵽƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������п��ɰ(��Ҫ��ZnO��ZnFe2O4������������FeO��CuO������)��ȡ����п�Ĺ����������£�

(1)���ʱҪ��п��ɰ���飬��Ŀ����������Ч�ʣ�Ϊ�ﵽ��һĿ�ģ����ɲ��õĴ�ʩ��_____(�δ�һ��)��д��ZnFe2O4����������ӷ���ʽ____________________________
(2)��������H2O2 ���뷴Ӧ�����ӷ���ʽΪ_________________________
(3)��������Y ����Ҫ�ɷ���________(�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ1 mL 0.1 mol��L-1AgNO3��Һ��������ʵ��(ʵ���������Լ�Ũ�Ⱦ�Ϊ0.1 mol��L-1)��

����˵������ȷ����
A.ʵ��ٰ�ɫ���������ܵ�AgClB.�����ڢ�˳��ʵ�飬�ܿ�����ɫ����
C.�����٢�˳��ʵ�飬�ܿ�����ɫ����D.��ʵ���˵�� AgI �� AgCl ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����Ĵ�������������Ȼ������ʡ���ͼ�Dzⶨ��Ʒ��̼��������������ʵ��װ�ã�����˵������ȷ���ǣ� ��

A.װ�����з����ķ�Ӧ����ʽΪH2SO4+Na2CO3=Na2SO4+CO2��+H2O
B.װ�ü������dz�ȥ�����еĶ�����̼����
C.��Ӧ���������軺���������������
D.��ʵ���������װ�ò�õ�̼���Ƶ������������ƫС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����з�Ӧ�ķ���ʽ�����ӷ���ʽ��
��1����ҵ�ƴֹ�ķ�Ӧ����ʽ��___��
��2��ͭ���Ȼ�����Һ�����ӷ���ʽ��___��
��3�����������������Һ��Ӧ�����ӷ���ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�10mL0.40mol/L H2O2�������ֽ⡣��ͬʱ�̲ⶨ����O2�������������Ϊ��״�������±���
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
������������ȷ���ǣ���Һ����仯���Բ��ƣ�
A��0~6min��ƽ����Ӧ���ʣ�v��H2O2��![]()
![]() mol/(L��min)
mol/(L��min)
B��6~10min��ƽ����Ӧ���ʣ�v��H2O2����![]() mol/(L��min)
mol/(L��min)
C����Ӧ��6minʱ��c��H2O2��=0.3mol/L
D����Ӧ��6minʱ��H2O2�ֽ���50%
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com