
【题目】(1)在25℃、1.01×105Pa时,16g硫粉在足量的氧气中充分燃烧生成二氧化硫气体,放出148.5kJ的热量,则S的燃烧热的热化学方程式为:_____________________。
(2)1L 1mol/L稀盐酸跟1L 1mol/L NaOH溶液起中和反应放出57.3kJ热量,其中和热的热化学方程为:________________。
(3)已知如图所示的可逆反应:

①A(g)+B(g)![]() 2C(g) +D(g);ΔH = Q kJ/mol则Q_______0(填“>”、“<”或“=”)
2C(g) +D(g);ΔH = Q kJ/mol则Q_______0(填“>”、“<”或“=”)
②反应体系中加入催化剂,反应速率增大,则E1的变化是: E1_______,ΔH的变化是:ΔH________(填“增大”“减小”“不变”)。
(4)发射卫星用![]() 作燃料,
作燃料,![]() 作氧化剂,两者反应生成N2和水蒸气,已知:N2(g) +2O2(g)= 2NO2(g)△H1 =+67.7kJ/mol;N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol,则1mol气体肼和NO2完全反应时的反应热△H=____________kJ/mol。
作氧化剂,两者反应生成N2和水蒸气,已知:N2(g) +2O2(g)= 2NO2(g)△H1 =+67.7kJ/mol;N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol,则1mol气体肼和NO2完全反应时的反应热△H=____________kJ/mol。
(5)反应A+3B=2C+2D在四种不同情况下的反应速率分别为:
①.v(A)=0.15mol/(Ls) ②.v(B)=0.6mol/(Ls)③.v(C)=0.4mol/(Ls) ④.v(D)=0.45mol/(Ls)则该反应进行最快的为________(填序号)
【答案】S(s)+O2(g)=SO2(g) △H=297kJ/mol; HCl+NaOH=NaOH+H2O ΔH= -57.3kJ/mol; < 减小 不变 1135.7 D
【解析】
(1)n(S)= ![]() =0.5mol,则1molS完全燃烧放出的热量为148.5kJ×2=297kJ,则热化学方程式为S(s)+O2(g)=SO2(g);△H=297kJ/mol;
=0.5mol,则1molS完全燃烧放出的热量为148.5kJ×2=297kJ,则热化学方程式为S(s)+O2(g)=SO2(g);△H=297kJ/mol;
(2)在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时所释放的热量叫做中和热;
(3)①A(g)+B(g ![]() 2C(g)+D(g);△H=QkJ/mol,图中反应物能量高于生成物能量,能量守恒可知反应为放热反应,反应焓变小于0,故答案为:<;②反应体系中加入催化剂,降低反应的活化能,E1减小,反应速率增大,但催化剂不改变平衡,不改变反应的焓变,△H不变;
2C(g)+D(g);△H=QkJ/mol,图中反应物能量高于生成物能量,能量守恒可知反应为放热反应,反应焓变小于0,故答案为:<;②反应体系中加入催化剂,降低反应的活化能,E1减小,反应速率增大,但催化剂不改变平衡,不改变反应的焓变,△H不变;
(4)①N2(g)+2O2(g)=2NO2(g) △H1=+67.7kJ/mol,②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=534kJ/mol,盖斯定律计算得到②×2①得到2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=1135.7kJ/mol;
(5)将不同物质表示的速率换算为同一物质表示的速率,再比较数值大小。以A物质为标准,则①v(A)=0.15mol·L-1·s-1;②v(A)=1/3v(B)= 1/3×0.6mol·L-1·s-1=0.2mol·L-1·s-1;③v(A)=1/2v(C)=1/2×0.5mol·L-1·s-1=0.25mol·L-1·s-1;④v(A)=v(D)=0.45mol·L-1·s-;即④的反应速率最快,以此解答。
(1)n(S)= ![]() =0.5mol,则1molS完全燃烧放出的热量为148.5kJ×2=297kJ,则热化学方程式为S(s)+O2(g)=SO2(g);△H=297kJ/mol,故答案为: S(s)+O2(g)=SO2(g)△H=297kJ/mol;
=0.5mol,则1molS完全燃烧放出的热量为148.5kJ×2=297kJ,则热化学方程式为S(s)+O2(g)=SO2(g);△H=297kJ/mol,故答案为: S(s)+O2(g)=SO2(g)△H=297kJ/mol;
(2)在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时所释放的热量叫做中和热。1L 1mol/L稀盐酸跟1L 1mol/L NaOH溶液起中和反应生成1 mol液态水,放出57.3kJ热量,故化学方程式为:HCl+NaOH=NaOH+H2O, ΔH= -57.3 kJ/mol;
(3)①A(g)+B(g ![]() 2C(g)+D(g);△H=QkJ/mol,图中反应物能量高于生成物能量,能量守恒可知反应为放热反应,反应焓变小于0,故答案为:<;
2C(g)+D(g);△H=QkJ/mol,图中反应物能量高于生成物能量,能量守恒可知反应为放热反应,反应焓变小于0,故答案为:<;
②反应体系中加入催化剂,降低反应的活化能,E1减小,反应速率增大,但催化剂不改变平衡,不改变反应的焓变,△H不变,故答案为:减小;不变;
(4)①N2(g)+2O2(g)=2NO2(g) △H1=+67.7kJ/mol,②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=534kJ/mol,盖斯定律计算得到②×2①得到2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=1135.7kJ/mol,故答案为: 1135.7;
(5)将不同物质表示的速率换算为同一物质表示的速率,再比较数值大小。以A物质为标准,则①v(A)=0.15mol·L-1·s-1;
②v(A)=1/3v(B)= 1/3×0.6mol·L-1·s-1=0.2mol·L-1·s-1;
③v(A)=1/2v(C)=1/2×0.5mol·L-1·s-1=0.25mol·L-1·s-1;
④v(A)=v(D)=0.45mol·L-1·s-;
即④的反应速率最快,故选D项。


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列分析中正确的是( )
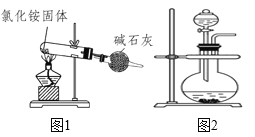
A.如图1装置能制得纯净的氨气
B.如图1中的氯化铵可用硝酸铵替代制备氨气
C.如图2可用浓氨水和氢氧化钠固体来制备氨气
D.如图1中碱石灰可用CaCl2替代来干燥氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对3NO2+H2O=2HNO3+NO反应的下列说法正确的是( )
A.NO2是氧化剂,H2O是还原剂
B.氧化产物与还原产物的物质的量之比为1∶2
C.氧化剂与还原剂的质量比为1∶2
D.在反应中若有6molNO2参与反应时,有3mol电子发生转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵是一种常用的化肥,其工业生产流程如图,请回答下列问题。

(1)写出反应容器B中发生反应的化学方程式:___。
(2)吸收塔C中通入空气的目的是___(用化学方程式解释);C、D两个反应容器中发生的反应,属于氧化还原反应的是___ (填反应容器代号)。
(3)浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因:___。
(4)碳与浓硝酸反应的化学方程式是___。
(5)检验产物硝酸铵中含有NH4+的方法是___。
(6)将盛有12mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,剩余的气体可能是___、___,则原混合气体中O2的体积可能为___mL或___mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学兴趣小组想制取饱和氯水,并进行氯水的性质实验。他们使用如图装置制取较多量的饱和氯水,请回答:

(1)写出仪器的名称:A_________。
(2)写出丙、丁装置中发生反应的离子方程式:丙_________,丁_______。
(3)有同学提出如下改进建议:

①在乙和丙之间增加上图中的a装置,你认为有无必要___ (填“有”或“无”)。
②在丙的长导管下口处,接上图中的b装置,可以提高氯气的吸收效果。原因是_______。
(4)用制得的氯水分别进行下列实验:①滴入碳酸钠溶液中,有气体生成,说明氯水中发生反应的粒子是____;②滴入AgNO3溶液中,发生反应的离子方程式是_____。
(5)用滴管将制得的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中。当滴到最后一滴时红色突然退去。产生上述现象的原因可能有两种(简要文字说明):①是由于____________;②是由于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏伽德罗常数的值,下列说法正确的是( )
表示阿伏伽德罗常数的值,下列说法正确的是( )
A.![]() 氢气中含有氢原子的数目为
氢气中含有氢原子的数目为![]()
B.标准状况下,![]() 苯中含有苯分子的数目为
苯中含有苯分子的数目为![]()
C.![]() 溶液中含有氯离子的数目为
溶液中含有氯离子的数目为![]()
D.![]() 与足量水反应,转移的电子数为
与足量水反应,转移的电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A(芳香烃)与E为原料制备J和高聚物G的一种合成路线如下:
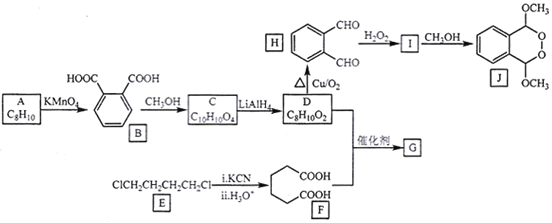
已知:①酯能被LiAlH4还原为醇
②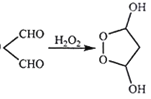
回答下列问题:
(1)A的化学名称是___________,J的分子式为__________,H的官能团名称为___________。
(2)由I生成J的反应类型为___________。
(3)写出F+D→G的化学方程式:______________________。
(4)芳香化合物M是B的同分异构体,符合下列要求的M有______种,写出其中2种M的结构简式:______________。
①1mol M与足量银氨溶液反应生成4 mol Ag
②遇氯化铁溶液显色
③核磁共振氢谱显示有3种不同化学环境的氢,峰面积之比1:1:1
(5)参照上述合成路线,写出用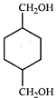 为原料制备化合物
为原料制备化合物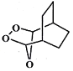 的合成路线(其他试剂任选)。____________________________________________________。
的合成路线(其他试剂任选)。____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学运用电解原理实现在铁棒上镀铜,设计如图装置,下列判断不正确是

A.a 是铁B.液体 c 可用硫酸铜溶液
C.该实验过程中c Cu2+变小D.b 上发生反应的方程式为 Cu-2e-= Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放(1)已知重整过程中部分反应的热化方程式为:
①CH4(g)=C(s)+2H2(g) ΔH>0
②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH>0
③CO(g)+H2(g)=C(s)+H2O(g) ΔH<0
固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。

同温度下CO2的平衡转化率________(填“大于”“小于”或“等于”)CH4的平衡转化率。
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g) ![]() 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com