
【题目】某中学化学兴趣小组想制取饱和氯水,并进行氯水的性质实验。他们使用如图装置制取较多量的饱和氯水,请回答:

(1)写出仪器的名称:A_________。
(2)写出丙、丁装置中发生反应的离子方程式:丙_________,丁_______。
(3)有同学提出如下改进建议:

①在乙和丙之间增加上图中的a装置,你认为有无必要___ (填“有”或“无”)。
②在丙的长导管下口处,接上图中的b装置,可以提高氯气的吸收效果。原因是_______。
(4)用制得的氯水分别进行下列实验:①滴入碳酸钠溶液中,有气体生成,说明氯水中发生反应的粒子是____;②滴入AgNO3溶液中,发生反应的离子方程式是_____。
(5)用滴管将制得的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中。当滴到最后一滴时红色突然退去。产生上述现象的原因可能有两种(简要文字说明):①是由于____________;②是由于________。
【答案】分液漏斗 Cl2+H2O![]() H++Cl-+HClO Cl2+2OH-=Cl-+ClO-+H2O 无 可增大Cl2与水的接触面积 H+ Ag++Cl- =AgCl↓ 盐酸中和了氢氧化钠 次氯酸将酚酞氧化了
H++Cl-+HClO Cl2+2OH-=Cl-+ClO-+H2O 无 可增大Cl2与水的接触面积 H+ Ag++Cl- =AgCl↓ 盐酸中和了氢氧化钠 次氯酸将酚酞氧化了
【解析】
甲装置为发生装置,实验室常用浓盐酸和二氧化锰共热制取氯气,方程式为:![]() ,由于浓盐酸具有挥发性,所以生成的氯气中混有HCl气体,装置乙中的饱和食盐水可将将其除去,丙中氯气与水反应,丁装置对尾气进行处理,据此分析作答。
,由于浓盐酸具有挥发性,所以生成的氯气中混有HCl气体,装置乙中的饱和食盐水可将将其除去,丙中氯气与水反应,丁装置对尾气进行处理,据此分析作答。
(1)根据其构造可知其为分液漏斗;
(2)丙中为氯气和水的反应,生成盐酸和次氯酸,方程式为:Cl2+H2O![]() H++Cl-+HClO;丁装置为除杂装置,吸收未反应的氯气,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
H++Cl-+HClO;丁装置为除杂装置,吸收未反应的氯气,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
(3) ①因氯气中含水对制备氯水无影响,所以在装置乙和丙之间增加装置戊[图(a)]无必要,故答案为:无;
②因多孔球泡的表面积大,能加快氯气溶解的速率,故答案为:可增大Cl2与水的接触面积;
(4)生成的气体为二氧化碳,碳酸根与过量氢离子反应可生成二氧化碳和水;氯水中含有氯离子,氯离子可以和银离子生成沉淀,离子方程式为:Ag++Cl-=AgCl↓;故答案为:H+; Ag++Cl-=AgCl↓
(5) 氢氧化钠酚酞溶液呈红色,向其中加入新制氯水,新制的氯水含有盐酸和次氯酸,红色褪去,原因可能为:①酚酞被强氧化剂HClO氧化而破坏;②NaOH被氯水中的酸性物质中和,故答案为:盐酸中和了氢氧化钠;次氯酸将酚酞氧化了;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】催化技术可处理汽车尾气:![]() ,某温度下在容积不变的密闭容器中通入NO和CO,不同时间NO和CO的浓度如下表.下列说法中不正确的是
,某温度下在容积不变的密闭容器中通入NO和CO,不同时间NO和CO的浓度如下表.下列说法中不正确的是
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A.2s内的平均反应速率![]()
![]()
B.在该温度下![]()
C.若将容积缩小为原来的一半,NO转化率大于![]()
D.某时刻再充入![]() molNO,
molNO,![]() molCO,重新达平衡后CO浓度比原平衡大
molCO,重新达平衡后CO浓度比原平衡大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1 mol NaOH固体溶于1 L水中,所得溶液的物质的量浓度为1 mol/L
B.40 g NaOH固体溶于100 g水中,所得溶液中溶质的质量分数为40%
C.标准状况下,22.4 L HCl气体溶于水中配成1 L溶液,所得溶液的物质的量浓度为1 mol/L
D.1 L物质的量浓度相同的溶液,所含溶质的质量一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确的关系是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确的关系是( )
A.4v(NH3)=5v(O2)B.5v(O2)=6v(H2O)
C.4v(NH3)=6v(H2O)D.4v(O2)= 5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质在水溶液中的电离方程式。
①CH3COOH _________ ② NaHSO4 __________________
(2)某温度下,纯水中的c(H+)=2×10-7 mol/L,则此时c(OH-)=______。若温度不变,滴入稀硫酸使c(H+)=5×10-6 mol/L,则由水电离出的c(H+)为_______ 。
(3)常温下,浓度均为0.01 mol/L 的两瓶溶液盐酸和氢氟酸,升高相同的温度,c(Cl-)/ c(F-)的值__________(填“变大”“变小”“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、1.01×105Pa时,16g硫粉在足量的氧气中充分燃烧生成二氧化硫气体,放出148.5kJ的热量,则S的燃烧热的热化学方程式为:_____________________。
(2)1L 1mol/L稀盐酸跟1L 1mol/L NaOH溶液起中和反应放出57.3kJ热量,其中和热的热化学方程为:________________。
(3)已知如图所示的可逆反应:

①A(g)+B(g)![]() 2C(g) +D(g);ΔH = Q kJ/mol则Q_______0(填“>”、“<”或“=”)
2C(g) +D(g);ΔH = Q kJ/mol则Q_______0(填“>”、“<”或“=”)
②反应体系中加入催化剂,反应速率增大,则E1的变化是: E1_______,ΔH的变化是:ΔH________(填“增大”“减小”“不变”)。
(4)发射卫星用![]() 作燃料,
作燃料,![]() 作氧化剂,两者反应生成N2和水蒸气,已知:N2(g) +2O2(g)= 2NO2(g)△H1 =+67.7kJ/mol;N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol,则1mol气体肼和NO2完全反应时的反应热△H=____________kJ/mol。
作氧化剂,两者反应生成N2和水蒸气,已知:N2(g) +2O2(g)= 2NO2(g)△H1 =+67.7kJ/mol;N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol,则1mol气体肼和NO2完全反应时的反应热△H=____________kJ/mol。
(5)反应A+3B=2C+2D在四种不同情况下的反应速率分别为:
①.v(A)=0.15mol/(Ls) ②.v(B)=0.6mol/(Ls)③.v(C)=0.4mol/(Ls) ④.v(D)=0.45mol/(Ls)则该反应进行最快的为________(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
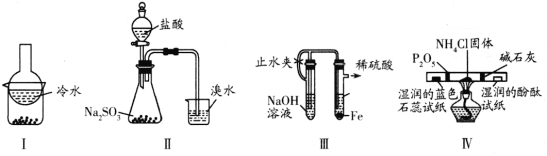
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质)制取金属锌的工艺流程如下:

(1)酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率,为达到这一目的,还可采用的措施是_____(任答一条)。写出ZnFe2O4溶于酸的离子方程式____________________________
(2)净化Ⅰ中H2O2 参与反应的离子方程式为_________________________
(3)净化Ⅱ中Y 的主要成分是________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com