
【题目】已知4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确的关系是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确的关系是( )
A.4v(NH3)=5v(O2)B.5v(O2)=6v(H2O)
C.4v(NH3)=6v(H2O)D.4v(O2)= 5v(NO)
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Cl2(g)=2HCl(g) ΔH= -184.6kJ/mol,则![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g)的ΔH为( )
Cl2(g)=HCl(g)的ΔH为( )
A.+184.6kJ/molB.-92.3kJ/molC.-369.2kJ/molD.+92.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对3NO2+H2O=2HNO3+NO反应的下列说法正确的是( )
A.NO2是氧化剂,H2O是还原剂
B.氧化产物与还原产物的物质的量之比为1∶2
C.氧化剂与还原剂的质量比为1∶2
D.在反应中若有6molNO2参与反应时,有3mol电子发生转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.高温条件下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应
B.实验室用![]() 与
与![]() 进行下列反应:
进行下列反应:![]()
![]()
![]() ;
;![]() ,当放出
,当放出![]() 热量时,
热量时,![]() 的转化率为
的转化率为![]()
C.常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进
D.等量的苛性钠溶液分别与pH为2和3的醋酸溶液恰好完全反应,设消耗醋酸溶液的体积依次为![]() 和
和![]() ,则
,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵是一种常用的化肥,其工业生产流程如图,请回答下列问题。

(1)写出反应容器B中发生反应的化学方程式:___。
(2)吸收塔C中通入空气的目的是___(用化学方程式解释);C、D两个反应容器中发生的反应,属于氧化还原反应的是___ (填反应容器代号)。
(3)浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因:___。
(4)碳与浓硝酸反应的化学方程式是___。
(5)检验产物硝酸铵中含有NH4+的方法是___。
(6)将盛有12mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,剩余的气体可能是___、___,则原混合气体中O2的体积可能为___mL或___mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学兴趣小组想制取饱和氯水,并进行氯水的性质实验。他们使用如图装置制取较多量的饱和氯水,请回答:

(1)写出仪器的名称:A_________。
(2)写出丙、丁装置中发生反应的离子方程式:丙_________,丁_______。
(3)有同学提出如下改进建议:

①在乙和丙之间增加上图中的a装置,你认为有无必要___ (填“有”或“无”)。
②在丙的长导管下口处,接上图中的b装置,可以提高氯气的吸收效果。原因是_______。
(4)用制得的氯水分别进行下列实验:①滴入碳酸钠溶液中,有气体生成,说明氯水中发生反应的粒子是____;②滴入AgNO3溶液中,发生反应的离子方程式是_____。
(5)用滴管将制得的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中。当滴到最后一滴时红色突然退去。产生上述现象的原因可能有两种(简要文字说明):①是由于____________;②是由于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A(芳香烃)与E为原料制备J和高聚物G的一种合成路线如下:
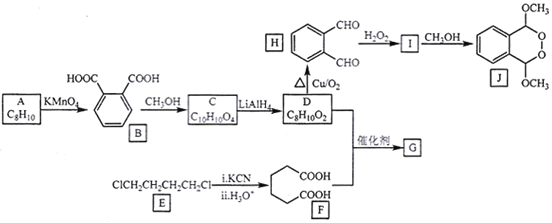
已知:①酯能被LiAlH4还原为醇
②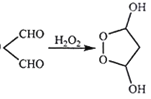
回答下列问题:
(1)A的化学名称是___________,J的分子式为__________,H的官能团名称为___________。
(2)由I生成J的反应类型为___________。
(3)写出F+D→G的化学方程式:______________________。
(4)芳香化合物M是B的同分异构体,符合下列要求的M有______种,写出其中2种M的结构简式:______________。
①1mol M与足量银氨溶液反应生成4 mol Ag
②遇氯化铁溶液显色
③核磁共振氢谱显示有3种不同化学环境的氢,峰面积之比1:1:1
(5)参照上述合成路线,写出用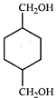 为原料制备化合物
为原料制备化合物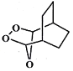 的合成路线(其他试剂任选)。____________________________________________________。
的合成路线(其他试剂任选)。____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系如下:O2![]() MnO(OH)2
MnO(OH)2![]() I2
I2![]() S4O62-
S4O62-
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_______________________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧,消耗0.010 00 mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L-1表示),写出计算过程_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com