
【题目】工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质)制取金属锌的工艺流程如下:

(1)酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率,为达到这一目的,还可采用的措施是_____(任答一条)。写出ZnFe2O4溶于酸的离子方程式____________________________
(2)净化Ⅰ中H2O2 参与反应的离子方程式为_________________________
(3)净化Ⅱ中Y 的主要成分是________(填化学式)。
【答案】适当增大c(H+)(或升高温度、搅拌等其他合理答案) ZnFe2O4+8H+===2Fe3++Zn2++4H2O H2O2+2Fe2++2H+===2Fe3++2H2O CuS、ZnS
【解析】
将锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等氧化物杂质)酸浸,发生反应ZnFe2O4+8H+===2Fe3++Zn2++4H2O、ZnO+2H+===Zn2++H2O、FeO+2H+===Fe2++H2O、CuO+2H+===Cu2++H2O,向溶液中加入双氧水,发生反应 2Fe2++2H++H2O2===2Fe3++2H2O,调节溶液的pH将Fe3+转化为Fe(OH)3沉淀,调节溶液pH时不能引进新的杂质,可以用ZnO,所以X为ZnO,然后向溶液中加入ZnS,发生反应Cu2++ZnS===Zn2++CuS,然后过滤,所以Y中含有CuS,最后电解得到Zn。
(1)酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率,为达到这一目的,还可采用的措施是适当增大c(H+)(或升高温度、搅拌等其他合理答案)。ZnFe2O4溶于酸的离子方程式ZnFe2O4+8H+===2Fe3++Zn2++4H2O。答案为:适当增大c(H+)(或升高温度、搅拌等其他合理答案);ZnFe2O4+8H+===2Fe3++Zn2++4H2O;
(2)净化Ⅰ中H2O2 参与反应的离子方程式为H2O2+2Fe2++2H+===2Fe3++2H2O。答案为:H2O2+2Fe2++2H+===2Fe3++2H2O;
(3)净化Ⅱ中Y 的主要成分是CuS、ZnS。答案为:CuS、ZnS。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】某中学化学兴趣小组想制取饱和氯水,并进行氯水的性质实验。他们使用如图装置制取较多量的饱和氯水,请回答:

(1)写出仪器的名称:A_________。
(2)写出丙、丁装置中发生反应的离子方程式:丙_________,丁_______。
(3)有同学提出如下改进建议:

①在乙和丙之间增加上图中的a装置,你认为有无必要___ (填“有”或“无”)。
②在丙的长导管下口处,接上图中的b装置,可以提高氯气的吸收效果。原因是_______。
(4)用制得的氯水分别进行下列实验:①滴入碳酸钠溶液中,有气体生成,说明氯水中发生反应的粒子是____;②滴入AgNO3溶液中,发生反应的离子方程式是_____。
(5)用滴管将制得的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中。当滴到最后一滴时红色突然退去。产生上述现象的原因可能有两种(简要文字说明):①是由于____________;②是由于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是一种将化学能转化为电能的高效、环境友好的发电装置.该电池的构造如图所示,下列分析判断错误的是

A.a极为负极,b极为正极
B.负极发生氧化反应
C.正极的电极反应为O2+2H2O+2e﹣═4OH﹣
D.负极的电极反应为H2+2OH﹣﹣2e﹣═2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系如下:O2![]() MnO(OH)2
MnO(OH)2![]() I2
I2![]() S4O62-
S4O62-
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_______________________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧,消耗0.010 00 mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L-1表示),写出计算过程_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积为1L的密闭容器中充入1molCO2和3.25molH2,发生CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,测得CH3OH的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数K=2.25)下列说法正确的是
CH3OH(g)+H2O(g) △H<0,测得CH3OH的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数K=2.25)下列说法正确的是
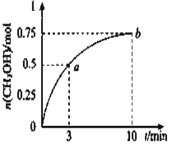
A.0-10min,v(H2)=0.075 mol/(L·min)
B.点 b 所对应的状态没有达到化学平衡状态
C.CH3OH 的生成速率,点 a 大于点 b
D.欲增大平衡状态时![]() ,可保持其他条件不变,升高温度
,可保持其他条件不变,升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放(1)已知重整过程中部分反应的热化方程式为:
①CH4(g)=C(s)+2H2(g) ΔH>0
②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH>0
③CO(g)+H2(g)=C(s)+H2O(g) ΔH<0
固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。

同温度下CO2的平衡转化率________(填“大于”“小于”或“等于”)CH4的平衡转化率。
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g) ![]() 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:

(1)“酸溶”时,Fe2O3与硫酸反应的离子方程式为___________________________。
(2)滤渣Ⅰ的主要成分是FeS2、S和________(填化学式);Fe3+被FeS2还原的离子方程式为_______________。
(3)“氧化”中,生成FeOOH的离子方程式为________________。
(4)滤液Ⅱ中溶质是Al2(SO4)3和________(填化学式):“洗涤”时,检验铁黄表面已洗涤干净的操作是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]() 。下列说法正确的( )
。下列说法正确的( )
A.在相同条件下,1mol![]() 与1mol
与1mol![]() 的能量总和大于2mol
的能量总和大于2mol![]() 的能量
的能量
B.1mol![]() 与1mol
与1mol ![]() 反应生成2 mol液态HF放出的热量小于270kJ
反应生成2 mol液态HF放出的热量小于270kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用下图来表示

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作得到的现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液 | 溶液褪色 | BaCl2溶液显酸性 |
B | 向25mL沸水中滴加5~6滴FeCl3饱和溶液,继续煮沸 | 生成红褐色沉淀 | 制得Fe(OH)3胶体 |
C | 向H2S溶液中滴加CuSO4溶液 | 生成蓝色沉淀 | H2S酸性比H2SO4强 |
D | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液 | 前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在I2和I- |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com