
【题目】下列实验操作得到的现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液 | 溶液褪色 | BaCl2溶液显酸性 |
B | 向25mL沸水中滴加5~6滴FeCl3饱和溶液,继续煮沸 | 生成红褐色沉淀 | 制得Fe(OH)3胶体 |
C | 向H2S溶液中滴加CuSO4溶液 | 生成蓝色沉淀 | H2S酸性比H2SO4强 |
D | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液 | 前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在I2和I- |
A.AB.BC.CD.D
【答案】D
【解析】
A、滴有酚酞的Na2CO3溶液呈红色是因为碳酸根离子水解溶液显碱性:CO32-+H2O![]() HCO3-+OH-,加入氯化钡,碳酸根离子和钡离子结合水解平衡逆向进行,氢氧根离子浓度减小,碱性减弱红色褪去,故A错误;
HCO3-+OH-,加入氯化钡,碳酸根离子和钡离子结合水解平衡逆向进行,氢氧根离子浓度减小,碱性减弱红色褪去,故A错误;
B、FeCl3饱和溶液在沸水中水解生成氢氧化铁胶体,为防止胶体聚沉,当溶液呈红褐色时停止加热,故B错误;
C、向H2S溶液中滴加CuSO4溶液生成CuS沉淀和硫酸,CuS为黑色沉淀,H2S酸性比H2SO4弱,故C错误;
D、向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,则KI3的溶液中含I2、I-,即KI3溶液中存在平衡为I3-![]() I2+I-,故D正确;
I2+I-,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质)制取金属锌的工艺流程如下:

(1)酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率,为达到这一目的,还可采用的措施是_____(任答一条)。写出ZnFe2O4溶于酸的离子方程式____________________________
(2)净化Ⅰ中H2O2 参与反应的离子方程式为_________________________
(3)净化Ⅱ中Y 的主要成分是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组拟探究改进Fe(OH)2的制取方法。
方案1:
①实验药品:FeS固体、稀硫酸溶液、NaHCO3溶液;
②实验装置如图1。
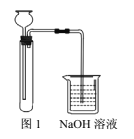
方案2:
①取一只试管,向其中加入一粒NaOH固体,再加入约2mL新制的FeSO4溶液;
②将试管置于酒精灯火焰上,对着有NaOH颗粒的部位小心加热(不能使液体剧烈沸腾)。使沉淀自下至上慢慢增多,观察下部沉淀颜色。
方案3:
①先在试管中滴入2~3 mL液体石蜡;
②用胶头滴管小心往试管底部注入4~5 mL新制的FeSO4溶液;
③再往试管中投入1粒绿豆大小的金属钠,观察反应现象。
回答下列问题:
(1)“方案1”中,后加入试管中的液体是______,NaOH溶液的作用是_______。
(2)“方案2”中,对着有NaOH颗粒的部位小心加热的目的是________。
(3)“方案2”的沉淀中,上层沉淀的颜色是________,下层沉淀的颜色是________,发生此现象的原因是________。
(4)“方案3”中反应的化学反应方程式为________。
(5)“方案3”的实验过程中间断性的出现白色沉淀,其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() ,发生反应:
,发生反应:![]() 。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
| 0 | 2 | 4 | 6 | 8 |
| 0 |
|
|
|
|
下列说法正确的是
A.反应在前2s的平均速率![]()
B.保持其他条件不变,体积压缩到![]() ,平衡常数将增大
,平衡常数将增大
C.相同温度下,起始时向容器中充入![]() ,达到平衡时,
,达到平衡时,![]() 的转化率大于
的转化率大于![]()
D.保持温度不变,向该容器中再充入![]() 、
、![]() ,反应达到新平衡时
,反应达到新平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变醋酸溶液的pH[溶液中c(CH3COOˉ)与c(CH3COOH)之和始终为0.1mol·Lˉ1],溶液中H+、OHˉ、CH3COOˉ及CH3COOH浓度的对数值(lgc)与pH关系如图所示。

下列说法错误的是
A. lgK(CH3COOH)=-9.26
B. 图中①表示 CH3COOH浓度的对数值与pH的关系曲线
C. 0.1mol·Lˉ1CH3COOH溶液的pH约为2.88
D. 0.1mol·Lˉ1CH3 COONa溶液的pH约为8.87
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中发生反应:xA(g) +B(g)![]() 2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是
2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是
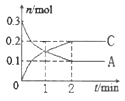
A. x=1
B. 反应进行到1min时,反应体系达到化学平衡状态
C. 2min后,A的正反应速率一定等于C的逆反应速率
D. 2min后,容器中A与B的物质的量之比一定为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L1·min1
B. 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C. 该温度,反应的平衡常数为11.25L·mol-1
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一密闭容器中进行,下列说法正确是
CO(g)+H2(g)在一密闭容器中进行,下列说法正确是
A.保持容器体积不变,增加C的物质的量,反应速率增大
B.保持容器体积不变,充入N2容器内气体压强增大,化学反应速率增大
C.保持压强不变,充入N2容器内气体压强不变,化学反应速率减小
D.保持容器体积不变,随着反应进行气体物质的量增多,压强增大,反应速率逐渐加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com