
【题目】下列分析中正确的是( )
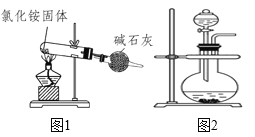
A.如图1装置能制得纯净的氨气
B.如图1中的氯化铵可用硝酸铵替代制备氨气
C.如图2可用浓氨水和氢氧化钠固体来制备氨气
D.如图1中碱石灰可用CaCl2替代来干燥氨气
科目:高中化学 来源: 题型:
【题目】结合元素周期表,回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图 1 中用实线补全元素周期表 的边界____________
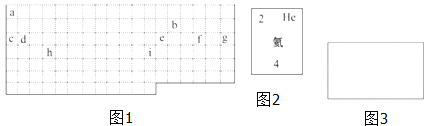
(2)表中所列元素,属于短周期元素的有____________;属于主族元素的有____________;g 元素位于第____________ 周期____________ 族;i 元素位于第____________ 周期____________族.
(3)元素 f 是第_______周期、第_______ 族元素,请在如图 3 所示的方框中按 氦元素(图 2)的式样写出该元素的原子序数、元素符号、元素名称、相对原子 质量_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿![]() 主要成份为
主要成份为![]() ,还含有
,还含有![]() 、
、![]() 等杂质
等杂质![]() 为主要原料生产红矾钠晶体
为主要原料生产红矾钠晶体![]() ,其主要工艺流程如图:
,其主要工艺流程如图:
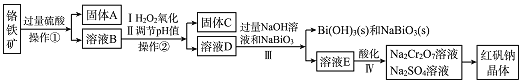
已知:![]() 在碱性条件下能将
在碱性条件下能将![]() 氧化为
氧化为![]() 。
。
![]() 固体A为 ______。
固体A为 ______。
![]() 实验室中操作
实验室中操作![]() 的名称为_____________。
的名称为_____________。
![]() 固体C中含有的物质是
固体C中含有的物质是![]()
![]() 和
和![]() ,则
,则![]() 的作用是 ______ 。
的作用是 ______ 。
已知:![]() ,
,![]() ,当
,当![]() 时
时![]() 开始沉淀.室温下,Ⅱ中需调节溶液pH范围为 ___
开始沉淀.室温下,Ⅱ中需调节溶液pH范围为 ___ ![]() 杂质离子浓度小于
杂质离子浓度小于![]() 视为沉淀完全
视为沉淀完全![]() 。
。
![]()
![]() Ⅳ中酸化是用硫酸而不用盐酸酸化,理由是 ______
Ⅳ中酸化是用硫酸而不用盐酸酸化,理由是 ______ ![]() 结合化学方程式回答
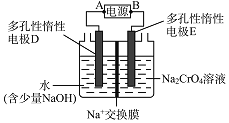
结合化学方程式回答![]() ;工业上也可设计如图示装置,用锂离子电池
;工业上也可设计如图示装置,用锂离子电池![]() 为难电离锂碳化合物
为难电离锂碳化合物![]() 为电源,电解
为电源,电解![]() 溶液制取
溶液制取![]() ,该装置工作时E电极的名称是 ___ 极;电源的A极的电极反应式为 ______
,该装置工作时E电极的名称是 ___ 极;电源的A极的电极反应式为 ______ ![]() 当电解过程中转移了
当电解过程中转移了![]() 电子时,理论上右侧溶液的质量减少 ______g。
电子时,理论上右侧溶液的质量减少 ______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
则常温常压下,NH3与NO2反应生成无污染物质的热化学方程式_____________。
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图所示:

写出该图示的总反应化学方程式:__________________。该反应需控制温度,温度过高时氨氮去除率降低的主要原因是______________。
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图所示:

当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是___。
(3)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如图所示:

①写出该活性原子与NO3-反应的离子方程式:________________。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化技术可处理汽车尾气:![]() ,某温度下在容积不变的密闭容器中通入NO和CO,不同时间NO和CO的浓度如下表.下列说法中不正确的是
,某温度下在容积不变的密闭容器中通入NO和CO,不同时间NO和CO的浓度如下表.下列说法中不正确的是
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A.2s内的平均反应速率![]()
![]()
B.在该温度下![]()
C.若将容积缩小为原来的一半,NO转化率大于![]()
D.某时刻再充入![]() molNO,
molNO,![]() molCO,重新达平衡后CO浓度比原平衡大
molCO,重新达平衡后CO浓度比原平衡大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,己知Co、Fe均为中等活泼金属)的工艺流程如图所示:

问答下列问题:
(l)(NH4)2C2O4中C元素的化合价为________。
(2)合金废料加入盐酸浸取,该盐酸不能换为硝酸,原因是____________。
残渣M的主要成分是一种金属单质,该金属为_______________,
(3)“浸出液”中先后加入的两种试剂涉及氨水、H2O2溶液,应先加入____________,加入氨水发生反应的离+方程式为____________________。
(4)溶液A中的金属阳离子是_________,加入(NH4)2C2O4溶液的目的是__________ 。
(5)“操作1”的名称是_________,草酸钴高温焙烧生成Co2O3,实验室中高温焙烧使用的仪器是_____(填字)。
a.蒸发皿 b.表面皿 c.烧杯 d.坩埚
(6)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。“操作2”中,蒸发浓缩后必须趁热过滤,其目的是_________________,90℃时Ksp(Li2CO3)的值为___________。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol·L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治疗癌症的有机小分子酯类药物X被批准使用。以芳香族化合物A为主要原料合成X的路线如下:
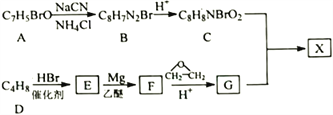
已知:
①核磁共振氢谱显示A有3种化学环境的氢,E只有1种化学环境的氢;
②![]()
③![]()
回答下列问题:
(1)A的名称是______________________;G中官能团名称是____________________。
(2)C在一定条件下反应生成高分子化合物,该反应的化学方程式为:__________________________。
(3)D生成E的反应类型为_____________________。
(4)X的结构简式为_____________________。
(5)已知:同一个碳原子若连有两个—OH时,易转化成![]() 。H是C的同分异构体,写出两种满足下列要求的H的结构简式______________________。
。H是C的同分异构体,写出两种满足下列要求的H的结构简式______________________。
①苯环上有两个取代基;
②能发生银镜反应,且在碱性条件下水解的两种产物也能发生银镜反应。
(6)参照上述合成路线和信息,用乙烯、乙醚、环氧乙烷为原料(其他无机试剂任选)合成1,6-己二酸_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用石墨电极电解MgCl2溶液:Mg2++2C1-+2H2O![]() Mg(OH)2↓+Cl2↑+H2↑
Mg(OH)2↓+Cl2↑+H2↑
B. 向明矾溶液中滴加碳酸钠溶液:2Al3++3CO32-==Al2(CO3)3↓
C. 向Ca(HCO3)2溶液中滴加少最NaOH溶液:Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O
D. 向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I-==3I2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、1.01×105Pa时,16g硫粉在足量的氧气中充分燃烧生成二氧化硫气体,放出148.5kJ的热量,则S的燃烧热的热化学方程式为:_____________________。
(2)1L 1mol/L稀盐酸跟1L 1mol/L NaOH溶液起中和反应放出57.3kJ热量,其中和热的热化学方程为:________________。
(3)已知如图所示的可逆反应:

①A(g)+B(g)![]() 2C(g) +D(g);ΔH = Q kJ/mol则Q_______0(填“>”、“<”或“=”)
2C(g) +D(g);ΔH = Q kJ/mol则Q_______0(填“>”、“<”或“=”)
②反应体系中加入催化剂,反应速率增大,则E1的变化是: E1_______,ΔH的变化是:ΔH________(填“增大”“减小”“不变”)。
(4)发射卫星用![]() 作燃料,
作燃料,![]() 作氧化剂,两者反应生成N2和水蒸气,已知:N2(g) +2O2(g)= 2NO2(g)△H1 =+67.7kJ/mol;N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol,则1mol气体肼和NO2完全反应时的反应热△H=____________kJ/mol。
作氧化剂,两者反应生成N2和水蒸气,已知:N2(g) +2O2(g)= 2NO2(g)△H1 =+67.7kJ/mol;N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol,则1mol气体肼和NO2完全反应时的反应热△H=____________kJ/mol。
(5)反应A+3B=2C+2D在四种不同情况下的反应速率分别为:
①.v(A)=0.15mol/(Ls) ②.v(B)=0.6mol/(Ls)③.v(C)=0.4mol/(Ls) ④.v(D)=0.45mol/(Ls)则该反应进行最快的为________(填序号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com