
【题目】工业上以铬铁矿![]() 主要成份为
主要成份为![]() ,还含有
,还含有![]() 、
、![]() 等杂质
等杂质![]() 为主要原料生产红矾钠晶体
为主要原料生产红矾钠晶体![]() ,其主要工艺流程如图:
,其主要工艺流程如图:
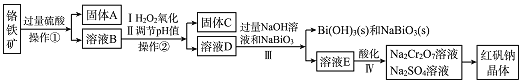
已知:![]() 在碱性条件下能将
在碱性条件下能将![]() 氧化为
氧化为![]() 。
。
![]() 固体A为 ______。
固体A为 ______。
![]() 实验室中操作
实验室中操作![]() 的名称为_____________。
的名称为_____________。
![]() 固体C中含有的物质是
固体C中含有的物质是![]()
![]() 和
和![]() ,则
,则![]() 的作用是 ______ 。
的作用是 ______ 。
已知:![]() ,
,![]() ,当
,当![]() 时
时![]() 开始沉淀.室温下,Ⅱ中需调节溶液pH范围为 ___
开始沉淀.室温下,Ⅱ中需调节溶液pH范围为 ___ ![]() 杂质离子浓度小于
杂质离子浓度小于![]() 视为沉淀完全
视为沉淀完全![]() 。
。
![]()
![]() Ⅳ中酸化是用硫酸而不用盐酸酸化,理由是 ______
Ⅳ中酸化是用硫酸而不用盐酸酸化,理由是 ______ ![]() 结合化学方程式回答
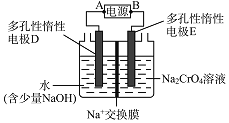
结合化学方程式回答![]() ;工业上也可设计如图示装置,用锂离子电池
;工业上也可设计如图示装置,用锂离子电池![]() 为难电离锂碳化合物
为难电离锂碳化合物![]() 为电源,电解
为电源,电解![]() 溶液制取
溶液制取![]() ,该装置工作时E电极的名称是 ___ 极;电源的A极的电极反应式为 ______
,该装置工作时E电极的名称是 ___ 极;电源的A极的电极反应式为 ______ ![]() 当电解过程中转移了
当电解过程中转移了![]() 电子时,理论上右侧溶液的质量减少 ______g。
电子时,理论上右侧溶液的质量减少 ______g。
【答案】![]() 过滤 氧化
过滤 氧化![]() ,使铁元素完全转化成沉淀而除去
,使铁元素完全转化成沉淀而除去 ![]()
![]()
![]() 阳
阳 ![]()
![]() 。
。
【解析】
铬铁矿![]() 主要成分为FeO和
主要成分为FeO和![]() ,含有
,含有![]() 、
、![]() 等杂质
等杂质![]() ,加入过量稀硫酸,只有
,加入过量稀硫酸,只有![]() 与稀硫酸不反应,则过滤得固体A为
与稀硫酸不反应,则过滤得固体A为![]() ,溶液B中含有
,溶液B中含有![]() 、
、![]() 、
、![]() ,在B中加入过氧化氢,可生成
,在B中加入过氧化氢,可生成![]() ,调节溶液pH可除去
,调节溶液pH可除去![]() 、
、![]() ,生成氢氧化铁、氢氧化铝沉淀,即固体C,溶液D含有
,生成氢氧化铁、氢氧化铝沉淀,即固体C,溶液D含有![]() ,在溶液D中加入
,在溶液D中加入![]() 和NaOH,发生氧化还原反应,过滤得溶液E含有
和NaOH,发生氧化还原反应,过滤得溶液E含有![]() ,酸化可得
,酸化可得![]() ,溶液经蒸发浓缩、冷却结晶可得
,溶液经蒸发浓缩、冷却结晶可得![]() ,以此解答该题。
,以此解答该题。
![]() 根据以上分析,固体A为
根据以上分析,固体A为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 根据以上分析,实验室中操作
根据以上分析,实验室中操作![]() 的名称为过滤,故答案为:过滤;
的名称为过滤,故答案为:过滤;
![]() 固体C中含有的物质是
固体C中含有的物质是![]() 和
和![]() ,则
,则![]() 的作用是氧化
的作用是氧化![]() ,使铁元素完全转化成沉淀而除去;当
,使铁元素完全转化成沉淀而除去;当![]() 时
时![]() 开始沉淀,室温下,除去
开始沉淀,室温下,除去![]() 溶液中的
溶液中的![]() 、
、![]() ,氢氧化铝完全变成沉淀时的pH:
,氢氧化铝完全变成沉淀时的pH:![]() ,
,![]() ,解得:
,解得:![]() ,
,![]() ,同理
,同理![]() 完全变成沉淀时,pH约为
完全变成沉淀时,pH约为![]() ,故pH范围是:
,故pH范围是:![]() ,故答案为:氧化
,故答案为:氧化![]() ,使铁元素完全转化成沉淀而除去;
,使铁元素完全转化成沉淀而除去;![]() ;
;
![]() 在溶液D中加入
在溶液D中加入![]() 和NaOH,发生氧化还原反应,生成
和NaOH,发生氧化还原反应,生成![]() 和
和![]() ,所以Ⅲ中发生反应的离子方程式为
,所以Ⅲ中发生反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
![]() Ⅳ中酸化是用硫酸而不用盐酸酸化,原因为
Ⅳ中酸化是用硫酸而不用盐酸酸化,原因为![]() 会氧化盐酸中的氯离子,反应离子方程式为:
会氧化盐酸中的氯离子,反应离子方程式为:![]() ;电解
;电解![]() 溶液制取
溶液制取![]() ,则E电极发生
,则E电极发生![]() ,说明E电极生成氢离子,电极反应为氢氧根失电子发生氧化反应,所以该装置工作时E电极的名称是阳极,B极为正极,A极为负极,电极反应式为
,说明E电极生成氢离子,电极反应为氢氧根失电子发生氧化反应,所以该装置工作时E电极的名称是阳极,B极为正极,A极为负极,电极反应式为![]() ;当电解过程中转移了
;当电解过程中转移了![]() 电子时,则右侧反应消耗
电子时,则右侧反应消耗![]() 氢氧根离子,放出
氢氧根离子,放出![]() 氧气,右侧移动到左侧的钠离子也为
氧气,右侧移动到左侧的钠离子也为![]() ,所以理论上右侧溶液的质量减少
,所以理论上右侧溶液的质量减少![]() ,故答案为:
,故答案为:![]() ;阳;
;阳;![]() ;
;![]() 。
。


科目:高中化学 来源: 题型:
【题目】ToC下,向体积为2 L的恒容密闭容器中通入NO2和O2,发生反应:4NO2(g)+O2(g)![]() 2N2O5(g)ΔH<0,部分实验数据如下表。下列说法不正确的是
2N2O5(g)ΔH<0,部分实验数据如下表。下列说法不正确的是
时间/s | 0 | 5 | 10 | 15 |
n(NO2)/mol | 8.00 | n1 | n2 | 4.00 |
n(O2)/mol | 2.00 | 1.25 | 1.00 | n3 |
A. 5s内NO2的平均反应速率为0.3 mol/(Ls)
B. 若10 s时,再向容器中充入2 mol N2O5(g),则新平衡下,NO2的体积分数将增大
C. 若5 s 时,改在绝热恒容下达平衡,新平衡下的平衡常数比原平衡的小
D. ToC,该反应的平衡常数为0.125,反应物的平衡转化率均为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能量是人类生存基础,因此化学反应与能量关系一直是研究热点,贯穿于生活和生产各个领域 .
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_______
(2)化学反应中放出的热能(焓变),△H与反应物和生成物的键能E有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol, E(H-H)=436kJ/mol,E(Cl-Cl)=243kJ/mol。
则E(H-Cl)=___________
(3)纳米级Cu2O由于具有优良的催化性能而受到关注,已知:
2Cu(s)+![]() O2(g)=CuO(s) △H=-169kJ.mol-1.
O2(g)=CuO(s) △H=-169kJ.mol-1.
C(s)+![]() O2(g)=CO(g) △H=-110.5kJ.mol-1
O2(g)=CO(g) △H=-110.5kJ.mol-1
2Cu(s)+O2(g)=2CuO(s) △H=-314kJ.mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu和CO的热化学方程__________
(4)如图是N2和H2反应生成2molNH3过程中能量变化示意图
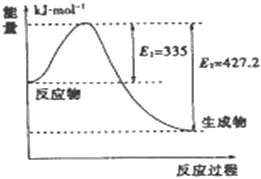
①请计算每生成1moNH3放出热量为___________
②若起始时向容器内放入1moN2和3molH2达平衡后N2的反应体积分数为20%,则反应放出的热量为Q1kJ,则Q1的数值为___________
(5)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是_______

A.氧分子的活化包括O-O键的断裂与C-O键的生成
B.每活化一个氧分子放出0.29eV的能量
C.水可使氧分子活化反应的活化能降低0.42eV
D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的![]() 、NO直接排放将对大气造成严重污染,利用电化学原理吸收
、NO直接排放将对大气造成严重污染,利用电化学原理吸收![]() 和NO,同时获得
和NO,同时获得![]() 和
和![]() 产品的工艺流程图如下
产品的工艺流程图如下![]() 为铈元素
为铈元素![]() 。
。
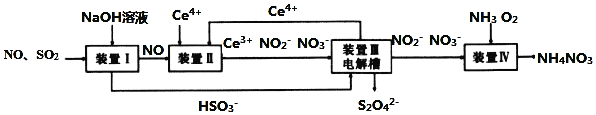
请回答下列问题.
![]() 若装置Ⅱ中反应生成的含氮化合物的物质的量比为1:1,则该反应的离子方程式____。
若装置Ⅱ中反应生成的含氮化合物的物质的量比为1:1,则该反应的离子方程式____。
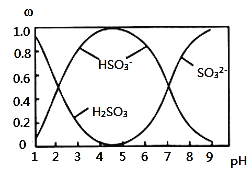
![]() 含硫各微粒
含硫各微粒![]() 、
、![]() 和
和![]() 存在于
存在于![]() 与NaOH溶液反应后的溶液中,它们的物质的量分数
与NaOH溶液反应后的溶液中,它们的物质的量分数![]() 与溶液pH的关系如图所示。
与溶液pH的关系如图所示。
![]() 下列说法中正确的是______
下列说法中正确的是______![]() 填标号
填标号![]() 。
。
A.![]() 溶液中滴加氯水可以使
溶液中滴加氯水可以使![]() 的值变大
的值变大
B.![]() 时,溶液中
时,溶液中![]()
C.![]() 时的溶液中
时的溶液中![]()
D.由图中数据,可以估算出![]() 的第二级电离平衡常数
的第二级电离平衡常数![]()
E.由图中数据,![]() 和
和![]() 时的溶液中水的电离程度相同
时的溶液中水的电离程度相同
![]() 若利用氨水吸收二氧化硫,其相关反应的主要热化学方程式如下:
若利用氨水吸收二氧化硫,其相关反应的主要热化学方程式如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
反应![]() ___
___![]() 。
。
![]() 取装置Ⅰ中的吸收液VmL,用
取装置Ⅰ中的吸收液VmL,用![]() 的酸性高锰酸钾溶液滴定.吸收液溶液应装在______
的酸性高锰酸钾溶液滴定.吸收液溶液应装在______![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 滴定管中,判断滴定终点的方法______。
滴定管中,判断滴定终点的方法______。
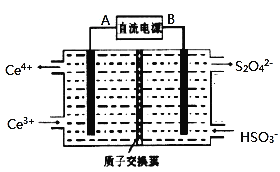
![]() 装置Ⅲ的作用之一是再生
装置Ⅲ的作用之一是再生![]() ,其原理如图所示,图中B为电源的______
,其原理如图所示,图中B为电源的______![]() 填“正”或“负”
填“正”或“负”![]() 极,左侧反应室中发生的主要电极反应式为______。
极,左侧反应室中发生的主要电极反应式为______。
![]() 已知进入装置Ⅳ的溶液中
已知进入装置Ⅳ的溶液中![]() 的浓度为
的浓度为![]() ,要使
,要使![]() 该溶液中的
该溶液中的![]() 完全转化为
完全转化为![]() ,该过程中转移电子数目为______。
,该过程中转移电子数目为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以菱镁矿![]() 主要成分为
主要成分为![]() ,含少量
,含少量![]()
![]() 为原料制备高纯氧化镁的实验流程如下:
为原料制备高纯氧化镁的实验流程如下:

![]() 滤液P中含有的阳离子有 ______。
滤液P中含有的阳离子有 ______。
![]() 过程Ⅱ中发生的氧化还原反应的离子方程式是 ______ 。
过程Ⅱ中发生的氧化还原反应的离子方程式是 ______ 。
![]() 已知:
已知:
|
|
| |
开始沉淀的pH |
|
|
|
沉淀完全的pH |
|
|
|
过程Ⅲ中加入![]() 调节溶液pH约为4,其目的是 ______ 。
调节溶液pH约为4,其目的是 ______ 。
![]() 过程Ⅳ在
过程Ⅳ在![]() 煅烧
煅烧![]() ,发生多个反应,产物除MgO外,还有
,发生多个反应,产物除MgO外,还有![]() 、
、![]() 、CO、S等气体产物,利用右图装置判断煅烧产生的气体。
、CO、S等气体产物,利用右图装置判断煅烧产生的气体。
![]() 中试管壁附着有淡黄色固体,该固体的化学式是 ______ 。
中试管壁附着有淡黄色固体,该固体的化学式是 ______ 。
![]() 中盛放的溶液是
中盛放的溶液是![]() 填字母
填字母![]() ______ 。
______ 。
![]() 溶液
溶液![]() 溶液
溶液 ![]() 稀硝酸
稀硝酸![]() 溶液
溶液
![]() 写出
写出![]() 煅烧
煅烧![]() ,产生气体产物是S和CO的化学方程式 ______ 。
,产生气体产物是S和CO的化学方程式 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分析中正确的是( )
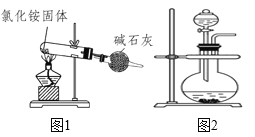
A.如图1装置能制得纯净的氨气
B.如图1中的氯化铵可用硝酸铵替代制备氨气
C.如图2可用浓氨水和氢氧化钠固体来制备氨气
D.如图1中碱石灰可用CaCl2替代来干燥氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对3NO2+H2O=2HNO3+NO反应的下列说法正确的是( )
A.NO2是氧化剂,H2O是还原剂
B.氧化产物与还原产物的物质的量之比为1∶2
C.氧化剂与还原剂的质量比为1∶2
D.在反应中若有6molNO2参与反应时,有3mol电子发生转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com