
分析 (1)①利用盖斯定律解答第一问,第二问中,书写K的表达式时注意只写g、aq,而不写l、s状态就行;
②工业生产中选择尾气吸收剂,主要看能否反应;
(2)利用溶度积常数计算溶液中亚硫酸根离子浓度;
(3)依据影响化学反应速率和化学平衡的因素分析判断;结合化学三段式列式计算平衡浓度,平衡常数等于生成物平衡浓度的幂次方乘积除以反应物平衡浓度幂次方乘积计算;
(4)二氧化硫的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,氢氧化钠的物质的量为:0.25L×2mol/L=0.5mol,二者按照1:1反应生成亚硫酸氢钠,由此分析解答;
解答 解:(1)①已知:
①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2=-110.5kJ•mol-1
据盖斯定律:②-①得 C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol-1,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol-1 ;
②在题给的四种物质中,CaCl2和NaHSO3不能与SO2反应,NaOH溶液和Na2CO3 可以反应,故答案为:ac;
(2)C(SO32- )=$\frac{Ksp(CaS{O}_{3})}{c(Ca{\;}^{2+})}$=$\frac{1.4×1{0}^{-7}}{0.70}$mol/L=2.0×10-7 mol/L,故答案为:2.0×10-7;
(3)N2(g)+O2(g)═2NO(g)△H>0,反应时气体体积不变的吸热反应,温度升高,反应速率加快,平衡右移,单位时间内NO排放量越大;
1mol空气中含有0.8mol N2和0.2mol O2,1300℃时在含1mol空气的密闭容器内反应达到平衡.测得NO为8×10-4mol.
N2(g)+O2(g)═2NO(g)
起始量(mol) 0.8 0.2 0
变化量(mol) 4×10-4 4×10-4 8×10-4
平衡量(mol)0.8-4×10-4 0.2-4×10-4 8×10-4
反应前后气体物质的量不变,用气体物质的量代替平衡浓度计算平衡常数K=$\frac{(8×1{0}^{-4})^{2}}{(0.8-4×1{0}^{-4})(0.2-4×1{0}^{-4})}$≈4×10-6;
故答案为:温度升高,反应速率加快,平衡右移;4×10-6;
(4)二氧化硫的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,氢氧化钠的物质的量为:0.25L×2mol/L=0.5mol,二者按照1:1反应生成亚硫酸氢钠,亚硫酸氢根离子电离大于水解,所以离子浓度大小关系为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
点评 本题考查了化学方程式书写,溶度积的应用,平衡常数的计算和离子浓度大小的比较,掌握基础是关键,题目较简单.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:多选题
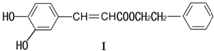
| A. | 遇FeCl3溶液可能显紫色 | |
| B. | 可发生酯化反应和银镜反应 | |
| C. | 能与溴发生取代和加成反应 | |
| D. | 1mol化合物I最多能与2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿:Fe3O4 | B. | 铜绿:Cu2(OH)2CO3 | C. | 磁铁矿:Fe2O3 | D. | 明矾:2KAl(SO4)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(l)△H=-483.6 kJ•mol-1,则2molH2(g)和1molO2(g)所含有的总能量比2molH2O(l)所含有的总能量少483.6kJ | |
| B. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 | |
| C. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 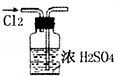 干燥Cl2 | |
| B. |  配制90ml 0.1mol•L-1硫酸溶液 | |
| C. |  分离沸点相差较大的互溶液体混合物 | |
| D. |  分离互不相溶的两种液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾霾天车灯照射的光亮通路属于丁达尔现象 | |
| B. | 二氧化碳、氢氧化物和可吸入颗粒物等是雾霾的主要成分 | |
| C. | 寒冷的冬天,餐桌上的火锅冒出的热气是水蒸气 | |
| D. | 减少户外活动,戴上口罩等是有效应对雾霾天气的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com