
| A. | 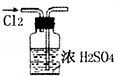 干燥Cl2 | |
| B. |  配制90ml 0.1mol•L-1硫酸溶液 | |
| C. |  分离沸点相差较大的互溶液体混合物 | |
| D. |  分离互不相溶的两种液体 |
分析 A.根据使用浓硫酸干燥Cl2时,进气导管应伸入浓硫酸的液面以下分析;
B.不能在容量瓶中稀释浓硫酸;
C.从温度计的使用目的角度分析解答;
D.根据分液实验的规范操作分析.
解答 解:A.图示的干燥装置中,进气导管连接错误,无法对Cl2进行干燥,图中操作错误应长管进短管出,故A错误;
B.容量瓶上有刻度,热胀冷缩影响其配制溶液的精确度,所以不能在容量瓶中稀释浓硫酸,应在烧杯中稀释后转移到容量瓶中,故B错误;
C.分离沸点相差较大的互溶液体混合物蒸馏时,温度计水银球应在蒸馏烧瓶支管口正中央,测不同液体的沸点,故C错误;
D.分离互不相溶的两种液体,可用分液的方法分离、提纯;分液时,密度大的液体在下方,为防止产生杂质,下层液体从下口流出,上层液体从上口倒出,故D正确;
故选D.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②③④⑤⑧ | C. | ①②③⑥⑧ | D. | ②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L盐酸 | B. | 0.01mol/L Na2CO3溶液 | ||
| C. | pH=4NaHSO3溶液 | D. | pH=11氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
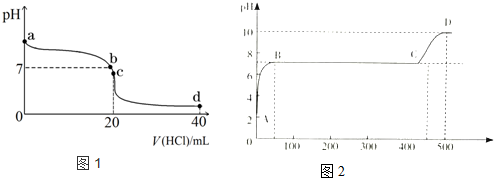
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汞 | B. | 氧化汞 | C. | 氧化铝 | D. | 硝酸铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
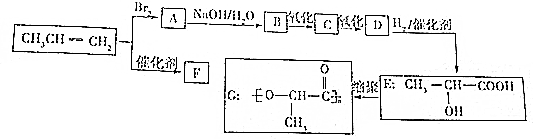
 .
.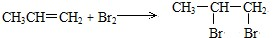 ,反应类型:加成反应;
,反应类型:加成反应;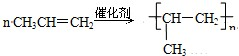 ,反应类型:加聚反应.
,反应类型:加聚反应.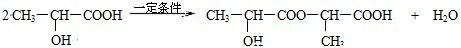 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
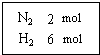 在一定温度下,把2mol N2和6mol H2通入一个体积不变的密闭容器 中(如右图)发生以下的反应:
在一定温度下,把2mol N2和6mol H2通入一个体积不变的密闭容器 中(如右图)发生以下的反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com