
| A. | 汞 | B. | 氧化汞 | C. | 氧化铝 | D. | 硝酸铝 |
分析 铝打磨后,表面的氧化物保护膜被去除,金属暴露出来,此时放入硝酸汞溶液中,则在表面发生置换反应,生成金属汞;汞能与铝结合成合金(铝汞齐),在铝汞齐表面的铝没有氧化铝保护膜的保护,很快被空气中的氧气氧化变成了白色固体氧化铝,由此分析解答.
解答 解:铝打磨后,表面的氧化物保护膜被去除,金属暴露出来,此时放入硝酸汞溶液中,则在表面发生置换反应,生成金属汞;汞能与铝结合成合金(铝汞齐),在铝汞齐表面的铝没有氧化铝保护膜的保护,很快被空气中的氧气氧化变成了白色固体氧化铝,随着铝汞齐表面的铝因氧化而减少,铝箔上的铝会不断溶解进入铝汞齐,并继续在表面被氧化,生成白色的氧化铝,最终形成“毛刷”,所以这里的“毛”可能是氧化铝,故选:C.
点评 本题考查了铝的化学性质应用,此题是结合实验对铝与汞性质的考查,解题的关键是掌握性质与现象的关系,属基础性知识考查题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、足量NaOH溶液 | H2 | H2O |
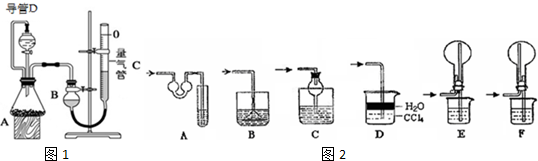
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 376.6mL |
| ② | 1.0g | 10.0mL | 364.7mL |
| ③ | 1.0g | 10.0mL | 377.0mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 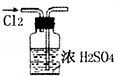 干燥Cl2 | |
| B. |  配制90ml 0.1mol•L-1硫酸溶液 | |
| C. |  分离沸点相差较大的互溶液体混合物 | |
| D. |  分离互不相溶的两种液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 39g苯中含有C═C键数为1.5NA | |
| B. | 0.5molFeBr2与标准状况下33.6L氯气反应时转移电子数为3NA | |
| C. | 1L0.5mol•L-1的NaClO溶液中含有的ClO-离子数为0.5NA | |
| D. | 常温常压下,14g由C2H4和C3H6组成的混合气体中含有的原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com