
| A、原子半径:丙>丁>乙 |
| B、甲与丙的原子核外电子数相差8 |
| C、丙的单质在空气中燃烧生成只含离子键的化合物 |
| D、最高价氧化物对应的水化物的碱性:丙>丁 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠、镁着火时可用泡沫灭火器扑灭 |
| B、为防止试管破裂,加热固体时试管口一般要略高于试管底 |
| C、1L PH=13的Ba(OH)2溶液中含有0.2NA个OH- 离子 |
| D、1.2克CH4所含有的共价键数与0.1 mol NH3所含的共价键数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2 |
| B、N2 |
| C、Br2 |
| D、F2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
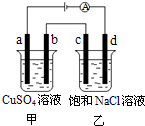 如图,a、b、c、d均为石墨电极,通电进行电解.下列说法正确的是( )
如图,a、b、c、d均为石墨电极,通电进行电解.下列说法正确的是( )| A、乙烧杯中d的电极反应为 2Cl--2e-═Cl2↑ |
| B、a、c两极产生气体的物质的量相等 |
| C、甲、乙两烧杯中溶液的pH均保持不变 |
| D、乙烧杯中通入适量HCl气体,溶液组成可以恢复 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+C02↑ |
| B、Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ |
| C、硫酸工业尾气中的SO2用过量的氨水吸收:2NH3?H2O+SO2=2NH4++SO32-+H2O |
| D、Cu溶于浓HNO3:Cu+4H++2NO3一=Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述I | 陈述Ⅱ |
| A | 明矾溶于水能产生Al(OH)3胶体, Al(OH)3胶体具有吸附性 | 明矾常用于对自来水进行杀菌消毒 |
| B | SO2有还原性 | SO2尾气可用NaOH溶液吸收 |
| C | NO是一种无色不溶于水的气体, NO遇空气会迅速变成红棕色 | 收集NO气体需用排水法,不能用排空气法 |
| D | Na有还原性 | 电解NaCl饱和溶液可制备Na |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、64.8 g |
| B、73.2 g |
| C、68.6 g |
| D、75.8 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com