
【题目】下列叙述中错误的是( )
A. 所有的非金属元素都在p区
B. 磷的外围电子排布方式为3s23p3
C. 碱金属元素具有较小的电负性
D. 当各轨道处于全满、半满、全空时原子较稳定
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)2016年9月G20峰会在杭州举行。
①峰会部分场馆使用了新型环保墙面材料硅藻泥。硅藻泥的主要成分SiO2属于________(填字母,下同)。
a. 有机高分子材料 b. 无机非金属材料 c. 金属材料
②峰会场馆空调使用CO2和水作制冷剂。不用氟利昂作制冷剂的目的是________。
a. 防治酸雨 b. 降低温室效应 c. 保护臭氧层
③央行发行了G20峰会金银合金纪念币。关于该纪念币的说法正确的是________。

a. 可以溶于盐酸
b. 相比纯金币,熔点高
c. 相比纯金币,硬度大
(2)紫薯营养丰富,具有特殊的保健功能。下表是100 g紫薯粉的营养成分含量表:
营养成分 | 含量(每100 g) | 营养成分 | 含量(每100 g) |
水分 | 9.9 g | 钙元素 | 23.00 mg |
脂肪 | 0.2 g | 铁元素 | 1.10 mg |
蛋白质 | 4.8 g | 硒元素 | 0.02 mg |
淀粉 | 82.5 g | 花青素 | 0.10 g |
纤维素 | 2.7 g | 其他 | …… |
①紫薯粉中的脂肪在人体内会水解成高级脂肪酸和________。
②以上营养成分中________是人体中含有的微量元素。
③紫薯中的花青素能消耗活性氧,具有________性(选填“氧化”或“还原”),可用于抗衰老。
④在酶的作用下,淀粉水解为葡萄糖,葡萄糖再转化为乙醇和二氧化碳。写出葡萄糖转化为乙醇的化学方程式__________________。
(3)防治环境污染,呵护生态环境是当今社会的主题之一。
①下列措施中,不能减少雾霾的是________(填字母)。
a. 禁止焚烧秸秆、树叶
b. 优选公交出行,减少汽车尾气排放
c. 提倡火力发电,提高燃煤使用量
室内装修中使用不合格大理石可能会释放放射性气体________。
②下列污水处理的方法只涉及到物理变化的是________(填字母)。
a. 活性炭吸附法 b. 化学沉淀法 c. 中和法
废水处理时通常加入明矾作为混凝剂以吸附水中的杂质,明矾水解的离子方程式为_______________________。
③用过的聚乙烯塑料食品袋要回收处理。聚乙烯的结构简式是________。
④锂电池为动力的新能源汽车可实现汽车低碳排放,锂电池属于________电池(选填“一次”或“二次”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:
Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq),当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )
Ca2+(aq)+2OH-(aq),当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )
A. 溶液中Ca2+数目不变 B. 溶液中c(Ca2+)增大
C. 溶液pH值不变 D. 溶液pH值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的O2和O3相比较,下列结论正确的是
A.它们的分子数目之比是 1∶1 B.它们的氧原子数目之比为 2∶3
C.它们的体积之比是 1∶1 D.它们的密度之比为 2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属单质跟一定浓度的硝酸反应,生成硝酸盐和氮氧化物等物质,假定只生成单一的还原产物,当参加反应的单质与被还原的硝酸的物质的量比为2:1时,还原产物可能是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能够大量共存的是( )
A.Ba2+、Cl-、NO3-、Ca2+ B.H+、Na+、SO42-、CO32-
C.Cu2+、K+、Cl--、OH- D.Ca2+、Na+、CO32、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有①0.2 mol·L-1NaOH溶液和②0.2 mol·L-1HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-)。则:
(1)①中由水电离出的c(OH-)__________②中由水电离出的c(H+)(填“>”、“=”或“<”)。
(2)上述混合液中共存在__________种粒子。其中:c(HX)+c(X-)__________0.1 mol·L-1(忽略混合前后溶液体积变化;填“>”、“=”或“<”)。请根据电荷守恒写出一个用离子浓度表示的等式:_____________________________________。
(3)上述混合液显__________性(填“酸”、“碱”或“中”),其原因用离子方程式表示为_______________________________________。
Ⅱ.海水中含有大量的元素,常量元素(如氯)、微量元素(如碘)在海水中均以化合态存在。在25 ℃时,向0.1 mol·L-1的NaCl溶液中逐滴加入适量的0.1 mol·L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1 mol·L-1的NaI溶液,看到的现象是___________________________,产生该现象的原因是(用离子方程式表示)__________________。
[已知25 ℃时Ksp(AgCl)=1.0×10-10、Ksp(AgI)=1.5×10-16]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新能源是解决环境污染的重要举措,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。
(1)已知:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)
ΔH1=-1 274.0 kJ/mol
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ/mol
③H2O(g)===H2O(l) ΔH3=-44 kJ/mol
甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为___________________________。
(2)生产甲醇的原料CO和H2可由反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH>0得到。
CO(g)+3H2(g) ΔH>0得到。
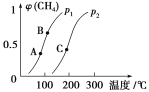
①一定条件下CH4的平衡转化率与温度、压强的关系如图。则p1________p2(填“<”、“>”或“=”)。A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为________________。
②100 ℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是________(填序号)。
a.容器的压强恒定
b.容器内气体密度恒定
c.3v正(CH4)=v逆(H2)
d.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
(3)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示,通入a气体的电极是原电池的________极(填“正”或“负”),其电极反应式为______________________________。
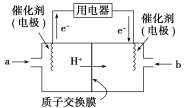
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的结构简式为___________,B的空间构型为__________________。
(2)在碘水中加入B振荡静置后的现象_______________________________。
(3)B与浓H2SO4和浓HNO3在50﹣60℃反应的化学反应方程式______________________。
B与H2在镍催化加热条件下反应的化学方程式__________________________________。
与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com