
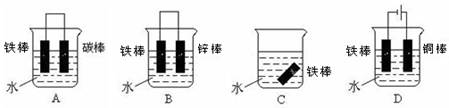
 2FW+3CO2 (2)BD (3)铜 Cu2++2e-=Cu 镀铜铁破损后,金属铁为负极,镀锌铁破损后,金属铁是正极,负极金属易被腐蚀
2FW+3CO2 (2)BD (3)铜 Cu2++2e-=Cu 镀铜铁破损后,金属铁为负极,镀锌铁破损后,金属铁是正极,负极金属易被腐蚀 2FW+3CO2。
2FW+3CO2。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源:不详 题型:单选题
 2PbSO4+2H2O
2PbSO4+2H2O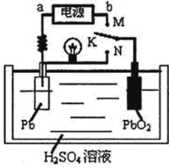
| A.实验室用铅蓄电池作电源电解饱和食盐水制取氯气,若制得氯气2.24L,则电池内消耗的H2SO4的物质的量是0.2mol |
| B.K与N相接时,H+向正极区迁移 |
| C.K与M连接时,所用电源的b极为负极 |
| D.K与M相接时,阳极附近的pH逐渐增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
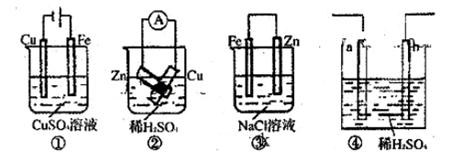
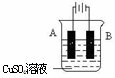
| A.图①连接好并放置片刻后,铁片会镀上一层铜 |
| B.图②连接好导线后(片与片相接触),电流表会发生明显偏转 |
| C.图③连接好并放置片刻后,在Zn片附近加一滴酚酞溶液,溶液变为红色 |
| D.图④发生反应为Fe+2H+=Fe2++H2↑时,a、b可能是同种材料的电极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
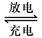 2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)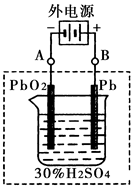
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.埋在潮湿土壤里的铁管比在干燥的土壤里更容易腐蚀 |
| B.在空气里金属银的表面生成一种黑色物质 |
| C.为保护海轮的船壳,常在船壳上镶上锌块 |
| D.镀银的铁制品,镀层损坏后,露出的铁表面更容易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.青铜(锡铜合金)中的锡可对铜起保护作用 |
| B.在海轮外壳上焊接上锌块,可减缓船体的腐蚀速率 |
| C.钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀的作用 |
| D.海水中钢闸门与电源的正极相连,可以防止闸门的腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
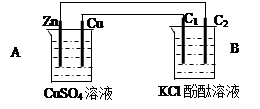
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com