
【题目】N2H4(联氨又称肼)一种重要的化工试剂,在生产和生活中有着重要的作用。
(1)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________________。
(2)N2H4是火箭升空需要高能的燃料,工业上利用N2和H2可以合成联氨(N2H4)等。已知:
N2(g)+2O2(g)= N2O4 (l) △H=-19.5kJ·mol-1
2H2(g)+O2(g) =2H2O(g) △H =-483.6 kJ·mol-1
2N2H4(1) +N2O4(l)= 3N2(g)+4H2O(g) △H = -1048.9 kJ·mol-1
写出N2和H2合成液态联氨(N2H4)的热化学方程式______________________________。火箭升空经常用联氨和N2O4反应作为火箭推进剂,其主要原因为______________________________。
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-═O2↑+2H2O,则阴极的电极反应式为___________________。有人提出,可以设计反应2CO= 2C+O2(△H >0)来消除CO的污染。请判断上述反应是否能自发进行并说明理由_____________________________。
【答案】 NaClO+2NH3=N2H4+NaCl+H2O N2(g)+2H2(g)=N2H4(l) ΔH= +50.6 kJ·mol1 放出大量热,产生大量气体 CO2+2e-+H2O=CO+2OH-或 2CO2+4e-+2H2O=2CO+4OH- 不能 ,因该反应的ΔH>0 , ΔS<0,所以反应不能自发进行
【解析】(1)氨气被次氯酸钠溶液氧化生成肼,次氯酸钠被还原生成氯化钠,结合原子守恒配平书写反应的化学方程式为:2NH3+NaClO═N2H4+NaCl+H2O,故答案为:2NH3+NaClO═ N2H4+NaCl+H2O;
(2)①N2(g)+2O2(g)= N2O4 (l) △H=-19.5kJ·mol-1,②2H2(g)+O2(g) =2H2O(g) △H =-483.6 kJ·mol-1,③2N2H4(1) +N2O4(l)= 3N2(g)+4H2O(g)△H = -1048.9 kJ·mol-1,依据热化学方程式和盖斯定律计算,将②-①×![]() -③×
-③×![]() 得:N2(g)+2H2(g)=N2H4(l) ΔH=(-483.6 kJ·mol-1)-(-19.5kJ·mol-1)×
得:N2(g)+2H2(g)=N2H4(l) ΔH=(-483.6 kJ·mol-1)-(-19.5kJ·mol-1)×![]() -(-1048.9 kJ·mol-1)×
-(-1048.9 kJ·mol-1)×![]() = +50.6 kJ·mol1,根据反应③可知,联氨和N2O4反应放出大量热且产生大量气体,因此可作为火箭推进剂,故答案为:N2(g)+2H2(g)=N2H4(l) ΔH= +50.6 kJ·mol1;反应放热量大,产生大量气体;
= +50.6 kJ·mol1,根据反应③可知,联氨和N2O4反应放出大量热且产生大量气体,因此可作为火箭推进剂,故答案为:N2(g)+2H2(g)=N2H4(l) ΔH= +50.6 kJ·mol1;反应放热量大,产生大量气体;
(3)2CO2═2CO+O2,CO可用作燃料,已知该装置的阳极反应为:4OH--4e-═O2↑+2H2O,阴极反应依据电子守恒总反应减去阳极反应得到:2CO2+4e-+2H2O═2CO+4OH-(或CO2+2e-+H2O ═ CO+2OH-);2CO═2C+O2 △H>0,△S<0,△H-T△S>0,反应一定不能自发进行,故答案为:2CO2+4e-+2H2O═2CO+4OH-(或CO2+2e-+H2O═CO+2OH-);不能,因该反应的ΔH>0,ΔS<0,所以反应不能自发进行。


科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电了数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。下列说法正确的是
A. Y的最高价氧化物对成水化物的酸性比W的强
B. W的气态氢化物比X的稳定
C. 离子半径的大小顺序:r(w)>r(X)>r(Y)>(Z)
D. XY2与ZY2中的化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+,又含有Fe3+,将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4g硫单质,0.425mol FeCl2 和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. 该盐酸的物质的量浓度为4.25mol·L-1
B. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
C. 成的H2S气体在标准状况下的体积为2.24L
D. 该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将agNH3完全溶于水,得到VmLpH=8的氨水,假设该氨水密度为ρg·cm3,溶质的质量分数为ω,其中含NH4+的物质的量为bmol,下列叙述中一定正确的是
A. 溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
B. 溶质的质量分数为ω=![]() ×100%
×100%
C. c(OH-)=(![]() +10-8)mol·L-1
+10-8)mol·L-1
D. 为使溶液的质量分数等于0.5ω,应加入VmL水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式为:
①C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol
②CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H2=﹣870.3kJ/mol
③H2(g)+ ![]() O2(g)=H2O(l)△H3=﹣285.8kJ/mol
O2(g)=H2O(l)△H3=﹣285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为( )
A.+488.3kJ/mol
B.﹣488.3kJ/mol
C.﹣244.15kJ/mol
D.+244.15kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应2NO2 ![]() 2NO+O2 , 在体积固定的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2 , 在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2 , 同时生成2n mol NO2;
②单位时间内生成n mol O2 , 同时生成2n mol NO;
③NO2、NO、O2的浓度比为2:2:1;
④混合气体的压强不再改变;
⑤混合气体的颜色不再改变;
⑥混合气体的平均摩尔质量不再改变.
A.①④⑤⑥
B.①②③⑤
C.②③④⑥
D.以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只分析图形不能得出的结论是( ) 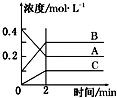
A.A是反应物
B.前2 min A的分解速率为0.1 molL﹣1min﹣1
C.达平衡后,若升高温度,平衡向正反应方向移动
D.反应的方程式为:2A(g)2B(g)+C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.SO2是一种重要的化工原料,其合理利用以及废气处理一直是化工研究的热点。
(1)氧元素在元素周期表中位于第______周期______族,硫原子核外有_____种能量不同的电子。
(2)元素的非金属性S比O______(填“强”或“弱”),从原子结构的角度解释原因:__________。
II.工业上利用反应SO2 + MnO2 → MnSO4 可以制备高纯 MnSO4,实验装置如下图:

(3)请标出反应SO2 + MnO2 → MnSO4的电子转移方向和数目____________
(4)在通入干燥空气的条件下,一段时间后,测得反应后溶液中的 n(SO42-)明显大于 n(Mn2+),请说明原因: ___________________。用化学方程式表示石灰乳的作用: ___________________。
III.SO2可用于处理含 Cr2O72-(铬元素化合价为+6)的废水,最后转化为铬沉淀(铬元素化合价为+3)除去。一种处理流程如下:
![]()
(5)NaHSO3与 Cr2O72-反应时,物质的量之比为__________。
【答案】 二 ⅥA 5 弱 硫原子半径大于氧原子半径,硫原子和氧原子的最外层电子数相等,硫原子的得电子能力比氧原子弱  在溶液中,空气中的氧气将二氧化硫氧化为 H2SO4 SO2+ Ca(OH)2→CaSO3+ H2O(或2SO2+2Ca(OH)2+O2→ 2CaSO4 + 2H2O) 3∶1
在溶液中,空气中的氧气将二氧化硫氧化为 H2SO4 SO2+ Ca(OH)2→CaSO3+ H2O(或2SO2+2Ca(OH)2+O2→ 2CaSO4 + 2H2O) 3∶1
【解析】试题分析:(1)氧原子核外有2个电子层,最外层有6个电子,硫原子核外电子排布式是1S22S22P63S23P4;(2)同主族元素最外层电子数相同,原子半径自上而下逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强;(3)反应SO2 + MnO2 → MnSO4中,硫元素化合价由+4升高为+6,锰元素化合价由+4降低为+2;(4)氧气能把二氧化硫氧化为 H2SO4;二氧化硫污染空气,用氢氧化钙能吸收二氧化硫;(5)NaHSO3与 Cr2O72-反应时,硫元素化合价由+4升高为+6,铬元素化合价由+6降低为+3,根据化合价升降相同计算物质的量之比。
解析:(1)氧原子核外有2个电子层,最外层有6个电子,所以氧元素在元素周期表中位于第二周期ⅥA族,硫原子核外电子排布式是1S22S22P63S23P4,有5个能级,所以有5种能量不同的电子;(2) 同主族元素最外层电子数相同,原子半径自上而下逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强,所以S非金属性比O弱;(3)反应SO2 + MnO2 → MnSO4中,硫元素化合价由+4升高为+6,硫失去2个电子,锰元素化合价由+4降低为+2,锰元素得到2个电子,所以电子转移方向和数目是 ;(4)氧气能把二氧化硫氧化为 H2SO4,所以反应后溶液中的 n(SO42-)明显大于 n(Mn2+);二氧化硫污染空气,氢氧化钙能吸收二氧化硫,反应方程式为SO2+ Ca(OH)2→CaSO3+ H2O;(5)NaHSO3与 Cr2O72-反应时,硫元素化合价由+4升高为+6,铬元素化合价由+6降低为+3,设NaHSO3与 Cr2O72-反应时的物质的量比为x∶y,根据化合价升降相同,2x=y×2×3,所以x∶y= 3∶1。
;(4)氧气能把二氧化硫氧化为 H2SO4,所以反应后溶液中的 n(SO42-)明显大于 n(Mn2+);二氧化硫污染空气,氢氧化钙能吸收二氧化硫,反应方程式为SO2+ Ca(OH)2→CaSO3+ H2O;(5)NaHSO3与 Cr2O72-反应时,硫元素化合价由+4升高为+6,铬元素化合价由+6降低为+3,设NaHSO3与 Cr2O72-反应时的物质的量比为x∶y,根据化合价升降相同,2x=y×2×3,所以x∶y= 3∶1。
点睛:氧化还原反应中,氧化剂得电子化合价降低,还原剂失电子化合价升高,根据氧化还原反应的升降规律,氧化剂得电子数一定等于还原剂失电子数。
【题型】综合题
【结束】
22
【题目】I.工业上可由氢气、氮气合成氨气,溶于水形成氨水。盐酸和氨水是实验室常见的电解质溶液。一定温度下,向2L 密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。
2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。

(1)0~2 min 内的平均反应速率 v(H2)=___________。
(2)该温度下,反应 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
T/ ℃ | 25 | 125 | 225 |
平衡常数 K | 4×106 | K1 | K2 |
试判断K1________K2(填写“>”“=”或“<”)。
(3)下列能说明合成氨反应已达到平衡状态的是______(填字母)(反应是在固定体积的密闭容器中进行的)
a.3v(N2) = v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
II.常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH 如下表。
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液 pH |
① | 0. 2 | 0.2 | pH=x |
② | c | 0.2 | pH=7 |
请回答:
(4)①中所得混合溶液, pH_______7(填“>”“<”或“=”)。
②中 c___0.2(填“>”“<”或“=”),所得混合溶液中各离子浓度大小关系为_____________。
(5)请你再设计一个能证明一水合氨是弱电解质的方案。_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含48.6% 的SiO2、16.2% 的ZnO、19.4% 的ZnS 和12 .8% 的CuS 及少量的Fe3O4。.某同学用10.0g该废催化剂为原料,回收锌和铜。采用的实验方案如下,回答下列问题:

已知:金属Zn 与Al类似,都是两性金属,能溶于强碱并放出氢气,但铝不溶于氨水,锌却可以溶于氨水形成四氨合锌配离子[Zn(NH3)4]2+。
(1)滤液1中含有Fe2+,选用提供的试剂进行检验,检验方法如下:__________________________。(提供的试剂:稀盐酸、KSCN 溶液、KMnO4 溶液、NaOH 溶液、K3[Fe(CN)6]溶液)
(2)滤渣2 除SiO2 外的另一成分是____________;第二次浸出时,加热温度不宜过高的原因是___________________;写出第二次浸出的化学反应方程式____________________________________。写出锌溶于氨水的离子方程式____________________________________。
(3)ZnSO4在水中的溶解度,随温度的升高而缓慢增大,从硫酸锌溶液得到七水硫酸锌晶体,可采用的方法是_____________________;析出七水硫酸锌晶体,减压过滤,用于淋洗七水硫酸锌晶体的溶剂是___________________;某同学在实验完成之后,得到5.74gZnSO4·7H2O(式量287)则锌的回收率为_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com