
【题目】已知某温度下,四种一元弱酸的电离平衡常数为:物质的量浓度都为0.1molL﹣1的下列溶液中,pH最小的是( )
HCN | HF | CH3COOH | HNO2 | |
Ka | 6.2×10﹣10 | 6.8×10﹣4 | 1.8×10﹣5 | 6.4×10﹣6 |
A.HCN
B.CHSCOOH
C.HF
D.HNOp
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.23gNa与足量H2O反应完全后失去2NA个电子
B.1molCu和足量热浓硫酸反应可生成NA个SO3分子
C.标准状况下,22.4LN2和H2混合气中含2NA个原子
D.3mol单质Fe完全转变为Fe3O4 , 失去9NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温常压下,将盛满氯气的一支试管倒立在水槽中,当日光照射一段时间至不再反应为止,试 管中最后残留气体体积占整个试管体积的( )
A. 1/2 B. 1/3 C. 1/4 D. 2/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,只含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

回答下列问题:
(1)上述反应,其中是氧化还原反应的有___个;写出试剂X的化学式___。
(2)反应②的离子反应方程式______________。
(3)反应①后过滤的沉淀为_____,简述确定此物质中金属元素及其价态的操作过程____。
(4)反应①后过滤时必须用到的玻璃仪器有______________。
(5)请你写出检验试剂X中含有阳离子的实验操作: ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列说法正确的是( )
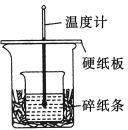
A.如图条件下实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填碎纸条的主要作用是固定小烧杯
D.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求放出热量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( ) 
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
C.加适量NH4Cl固体可使溶液由a点变到b点
D.c、d两点代表的溶液中c(H+)与c(OH﹣)乘积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mL 0.018molL﹣1的AgNO3溶液中加入50mL 0.02molL﹣1的盐酸生成沉淀.已知Ksp(AgCl)=1.8×10﹣10 , 则生成沉淀后的溶液中c(Ag+)与pH分别为( )
A.1.8×10﹣7 molL﹣1 , 2
B.1×10﹣7 molL﹣1 , 2
C.1.8×10﹣7 molL﹣1 , 3
D.1×10﹣7 molL﹣1 , 3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com