


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①④ | D、④⑤ |
查看答案和解析>>
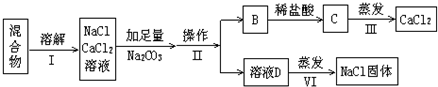
科目:高中化学 来源: 题型:
| PH | 6.5-8.5 |
| Ca2+、Mg2+总浓度 | <0.0045mol?L-1 |
| 细菌总数 | <100个?mL-1 |
查看答案和解析>>
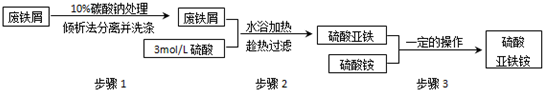
科目:高中化学 来源: 题型:
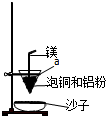
查看答案和解析>>
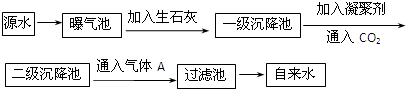
科目:高中化学 来源: 题型:
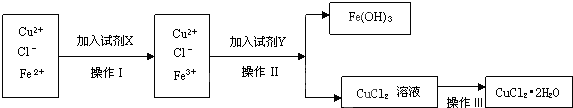
查看答案和解析>>
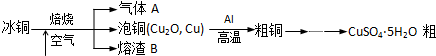
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
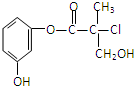 某有机物A是生产有机农药“杀螨灵”的一种中间体,其结构简式如图.则下列叙述正确的是( )
某有机物A是生产有机农药“杀螨灵”的一种中间体,其结构简式如图.则下列叙述正确的是( )| A、有机物A属于芳香烃 |
| B、有机物A与 Br2的CCl4溶液容易发生加成反应 |
| C、有机物A和浓硫酸混合加热,可以发生消去反应 |
| D、1mol A和足量的NaOH溶液反应,最多可以消耗4mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在任何条件下,化学平衡常数是一个恒定值 |
| B、从平衡常数K的大小可以推断一个反应进行的程度 |
| C、平衡常数K只与温度有关,与反应起始浓度、压强无关 |
| D、改变反应物浓度或生成物浓度都会改变平衡常数K |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com