


科目:高中化学 来源: 题型:
| 盐酸体积(mL) | 20 | 40 | 60 | 80 |
| 产生气体体积(mL) | 0 | 560 | 1680 | 2520 |
| A、加入盐酸体积小于20 mL时,体系发生的离子反应为:CO32-+H+═HCO3- |
| B、加入盐酸体积为50 mL时,产生气体(标准状况)的体积为1120mL |
| C、本实验使用盐酸的浓度为2.5 mol?L-1 |
| D、该天然碱的化学式为Na2CO3?2NaHCO3?2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
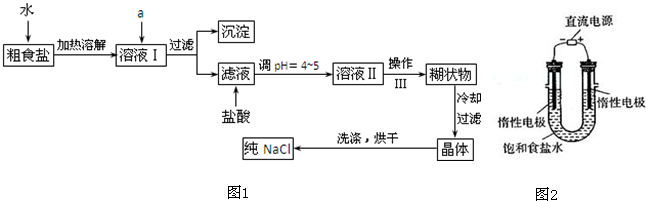
查看答案和解析>>
科目:高中化学 来源: 题型:
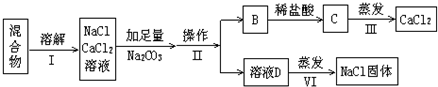
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化锰与浓盐酸制Cl2 |
| B、过氧化钠与水制O2 |
| C、锌与稀硫酸制H2 |
| D、电石与水制取C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
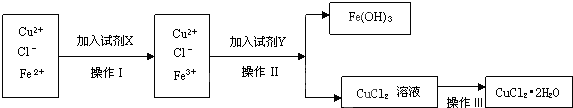
科目:高中化学 来源: 题型:
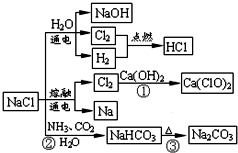
| A、反应②③是侯氏制碱法的原理 |
| B、反应①中的Ca(ClO)2是还原产物 |
| C、常温下干燥Cl2可储存于钢瓶中,所以Cl2与铁不反应 |
| D、图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
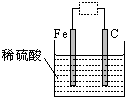
| A、虚线框中接灵敏电流计,铁被腐蚀,并能将电能转化为化学能 |
| B、虚线框中保持断开状态,铁可能不会被腐蚀 |
| C、虚线框中接直流电源,铁可能不会被腐蚀 |
| D、虚线框中无论接灵敏电流计还是直流电源,铁都会加快腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com